Secondaire 5 • 1a
Bonjour Alloprof!
J'ai consulté votre site sur le bilan énergétique et je ne comprends toujours pas pourquoi dans l'équation suivante l'enthalpie du C4H10O est négative (dans le corrigé) alors que c'est un réactif et que son enthalpie devrait donc être positive comme mentionné dans votre fiche.

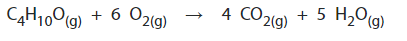






Explication d'Alloprof
Cette explication a été donnée par un membre de l'équipe d'Alloprof.
Salut !
Cela va dépendre de quel enthalpie il s'agit. Dans le cas de l'enthalpie de réaction globale. Si on prend ce sens de la réaction où il y a production de CO\(_2\) et de H\(_2\)O, il s'agit d'une combustion qui dégage de l'énergie. Ainsi, si on écrit l'enthalpie de réaction du côté des réactifs, il y a dégagement de chaleur et ce la te donne un signe positif.
Une réaction inverse te demanderais de l'énergie. Et donc, si tu places l'énergie du côté des réactifs, elle sera négative.
Mais en effet, dans le cas que tu montre, C\(_4\)H\(_{10}\)O te demande un apport en énergie pour briser ses liaisons.
Si tu as d'autres questions ou des précisions, n'hésite pas !
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!