Liste de discussions
-
Vérifiée par Alloprof
Secondaire 5 • 5jcomment puis-je le calculer
-
Vérifiée par Alloprof
Secondaire 5 • 5jBonjour, je veux trouver la masse molaire d'un gaz et pour cela j'ai besoin de PV= nRT et M = m/n. Pour la variable pression, je peux utiliser la pression atmosphérique, celle de base donc 101,3 kPa ? Sinon comment le savoir sans utiliser un baromètre ? Deuxièmement, pour la température, par exemple, le gaz est dans une classe. Si je n'ai pas de thermomètre, 20 degrés Celsius seraient-ils une bonne mesure pour la température d'une classe ?
-
Vérifiée par Alloprof
Secondaire 5 • 7jJe ne comprend pas les calculs à faire quand un manomètre et fermé et ouvert
-
Vérifiée par Alloprof
Postsecondaire • 7jBonjour, j’ai besoin d’aide avec ce problème (chimie générale). La réponse est 16,7 kPa de O2 et 33,3 kPa de NO2, mais je ne comprends pas comment faire. Merci!
-
Vérifiée par Alloprof
Secondaire 3 • 8jPourquoi on éternue?
-
Vérifiée par Alloprof
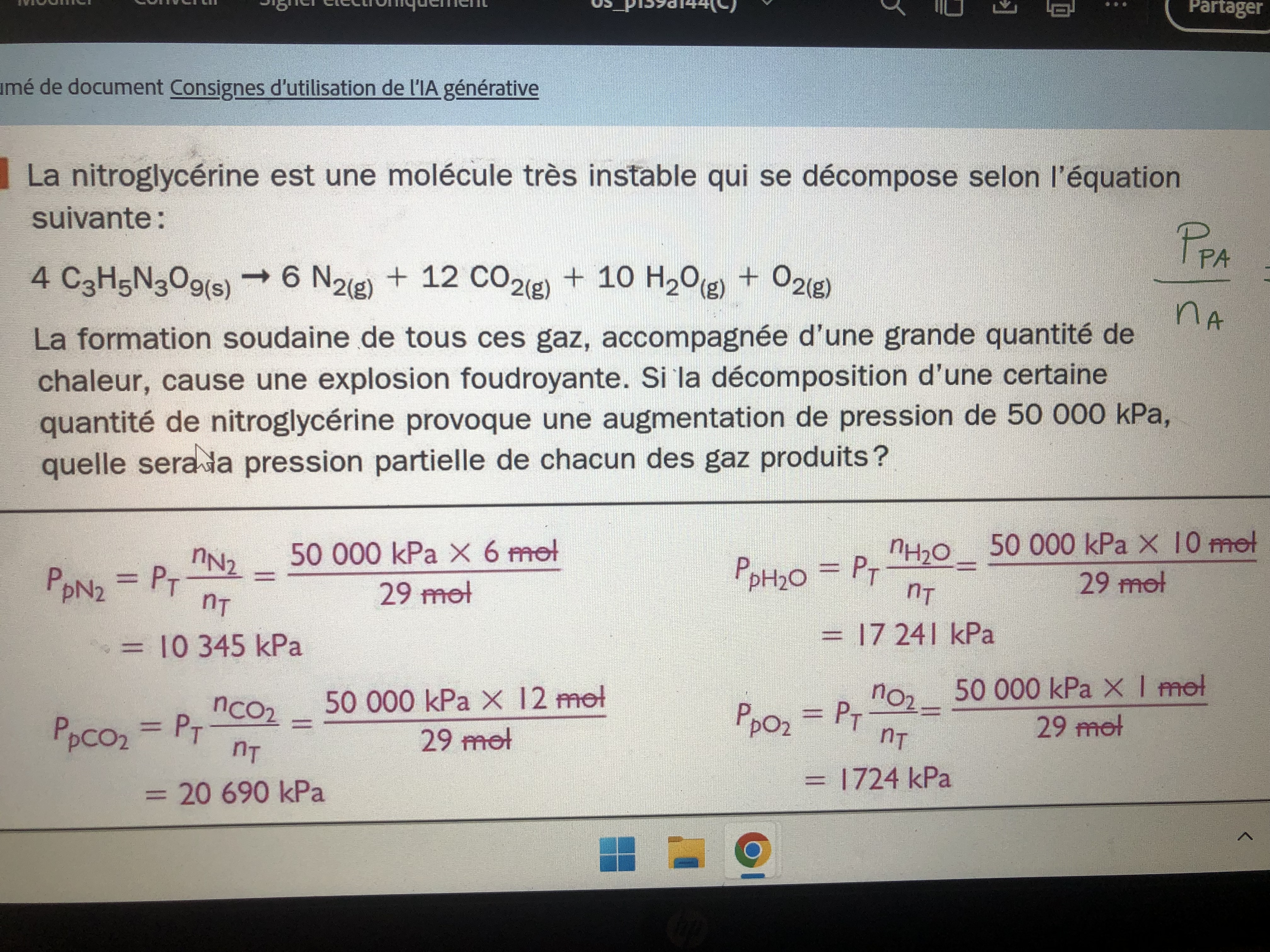
Secondaire 5 • 9jBonsoirr pourriez vous m’expliquer pourquoi le nombre de mole total est de 29 ici svp?
-
Vérifiée par Alloprof
Secondaire 5 • 10jJe ne comprend pas comment résoudre le numéro 34
-
Vérifiée par Alloprof
Secondaire 5 • 11jHello! I just had a question concerning thermochemistry : why do we say that when water freezes, its exothermic? I dont get it. I know exothermic is when the system releases heat to the surrounding , the surrounding absorbs that heat which increases the temperature, leading to the container to feel hot. But when water freezes , its not hot??
thank you!
-
Vérifiée par Alloprof
Secondaire 5 • 12jQu'est-ce qui distingue la chaleur et la température
-
Vérifiée par Alloprof
Secondaire 5 • 13jJe ne comprend pas les lois sur les pressions partielles des gazs. Par exemples, quand deux bonbonnes à pression et aux nombre de mole de mole différent se joignent, leur pression s'additionne. J'ai l'impression que ce devrait être plutot P*n +P*n, ou n est le nombre de mole.
-
Vérifiée par Alloprof
Postsecondaire • 15jSalut ! Je me demandais comment on peut connaitre l'hybridation d'un atome. Exemple, la molécule NH3.
-
Vérifiée par Alloprof
Secondaire 5 • 16jBonsoir,
Je ne parviens pas à arriver à la réponse (qui est encerclée en rouge) dans la question suivante. J’aimerais donc avoir des explications.Merci et bonne soirée,
LucioleLucide6774
-
Vérifiée par Alloprof
Secondaire 5 • 17jAllo, j'aimerais savoir par rapport à quoi je dois calculer la vitesse moyenne de ma réaction si je sais que la courbe de réactif est symétrique à celle du produit et que le réactif à 2 mol alors que le produit en a 1
Aussi, pouvez-vous me donner la différence entre la vitesse moyenne et la vitesse moyenne globale ?
Merci !
-
Vérifiée par Alloprof
Secondaire 5 • 17jBonsoir!
J'ai fait un exercice de chimie, mais je n'arrive pas à la bonne réponse et je ne trouve pas mon erreur (à la question b)). Je suis arrivée à 17,6g, mais la réponse est 27,2g. Est-ce que quelqu'un peut m'expliquer comment faire ce numéro?
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 17jJe calcul la relation entre pression et température dans un lab sur la loi de Gay Lussac, j'ai un graphique pression selon température mais je dois prendre les deux points les plus près de ma courbe de tendance pour les remplacer dans la loi de Gay Lussac. Je crois que des deux côtés de l'égalité ca donnera une valeur théorique et une expérimentale. Je ne comprend pas comment c'est possible. Sinon, qu'est-ce qui serait logique de faire.
-
Vérifiée par Alloprof
Secondaire 5 • 17jBonjour pouvez vous m’aider avec ce problème?Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 19jquelle serait la démarche de cette question: Combien de ballons de 100,0 L peut-on remplir à TAPN avec une bonbonne contenant de 10,00 L d'hélium à 15000 Kpa et à 15,00 degré celsius ?
-
Vérifiée par Alloprof
Secondaire 2 • 19jpeut tu maider a comprendre les composes ioniques et covalents
-
Vérifiée par Alloprof
Secondaire 5 • 20jJe ne comprends pas comment calculer la vitesse instantanée.. Nous avons exécuter un laboratoire en classe avec une burette à gaz (en prenant les données), par la suite mon prof nous à demander de répondre à des questions comme " calculez la vitesse instantanées de formation de dihydrogène en mL/s après le premier tiers de la réaction à 360 s. Je ne comprend pas comment faire...
-
Vérifiée par Alloprof
Secondaire 5 • 22jJe dois trouver des causes d’erreurs et leurs améliorations ( pas deja dit dans le protocole) ? Merci
Vous utiliserez une burette à gaz pour recueillir l'hydrogène gazeux par déplacement d'eau.
1. Remplir un bécher de 800 ml au 2/3 avec de d'eau.
2. Fixer une pince à burette à un support universel, assez haut pour soutenir une burette à gaz.
3.Incliner la burette à gaz et verser 10 mL d’une solution aqueuse de chlorure d’hydrogène (HCl) à 19,9% en masse (la masse volumique de la solution est de 1,10 g/mL).
4. Remplir la burette d'eau distillée en faisant couler l'eau doucement le long de la paroi pour éviter qu'elle ne se mélange à l'acide. Frapper doucement les parois de la burette pour déloger les bulles qui s’y seraient fixées .
5. Obtenir un morceau de magnésium en ruban, noter son numéro et le peser. Noter précisément sa masse. Enrouler ce ruban de façon à ce qu’il puisse être introduit dans une espèce de petite cage faite de fil de cuivre reliée à un bouchon troué.
6. Introduire la cage de cuivre contenant le magnésium dans la burette. La burette devrait être complètement remplie de façon à ce qu’il y ait un peu d’eau qui déborde par le bouchon troué.
7. Placer un doigt sur l'extrémité de la burette et l'inverser. Plonger la burette inversée dans le bécher rempli d'eau. Retiree son doigt. Fixer la burette à l’aide de la pince fixée à un support universel. La solution de HCl est plus dense que l'eau, elle descendra pour réagir avec le magnésium.
8. Lorsque tout le magnésium aura réagi, attendre 5 minutes pour laisser le tube revenir à la température de la pièce. Déloger les bulles qui adhèrent à la paroi du tube.
9. Noter les mesures suivantes : la différence entre les niveaux des liquides dans la burette et dans le bécher, le volume de gaz sur la burette, la température de la solution dans le bécher et la pression barométrique.
10. Répéter les étapes 3 à 9 avec un autre échantillon de magnésium. Bien rincer le bécher et la burette avant de procéder.
-
Vérifiée par Alloprof
Secondaire 5 • 23jJe comprend pas ce numéro là, la loi des gaz générale.
-
Vérifiée par Alloprof
Secondaire 5 • 24jJe ne comprend pas quoi faire pour trouver le volume
-
Vérifiée par Alloprof
Secondaire 4 • 24jEst-ce que je dois mettre un 3 à H2O pour ma réponse? Même ça serait quoi la réponse exacte pour confirmer mes erreur pour le numéro 6 a)? Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 24jNonjour
je ne comprend pas cette question. Comment savoir si la réaction est endothermique ou exothermique si on a pas aucune information sauf qu’il y a une diminution de température
-
Vérifiée par Alloprof
Secondaire 5 • 25jJe ne comprend pas cette question car la on sait si la réaction est endo ou exo mais je ne sais pas c’est quoi le rapport
-
Vérifiée par Alloprof
Secondaire 5 • 25jFaire la différence entre énergie cinétique moyenne et vitesse des gaz ainsi que ce qui les font varier (température et masse molaire)
-
Vérifiée par Alloprof
Secondaire 5 • 26jBonjour!
Aviez-vous un rapport de laboratoire en modèle spécifiquement en CHIMIE SEC-5?
Merci!
-
Vérifiée par Alloprof
Secondaire 4 • 27jComment peut-on reconnaître un acide, une base et un sel en observant la formule moléculaire d’une substance?
-
Vérifiée par Alloprof
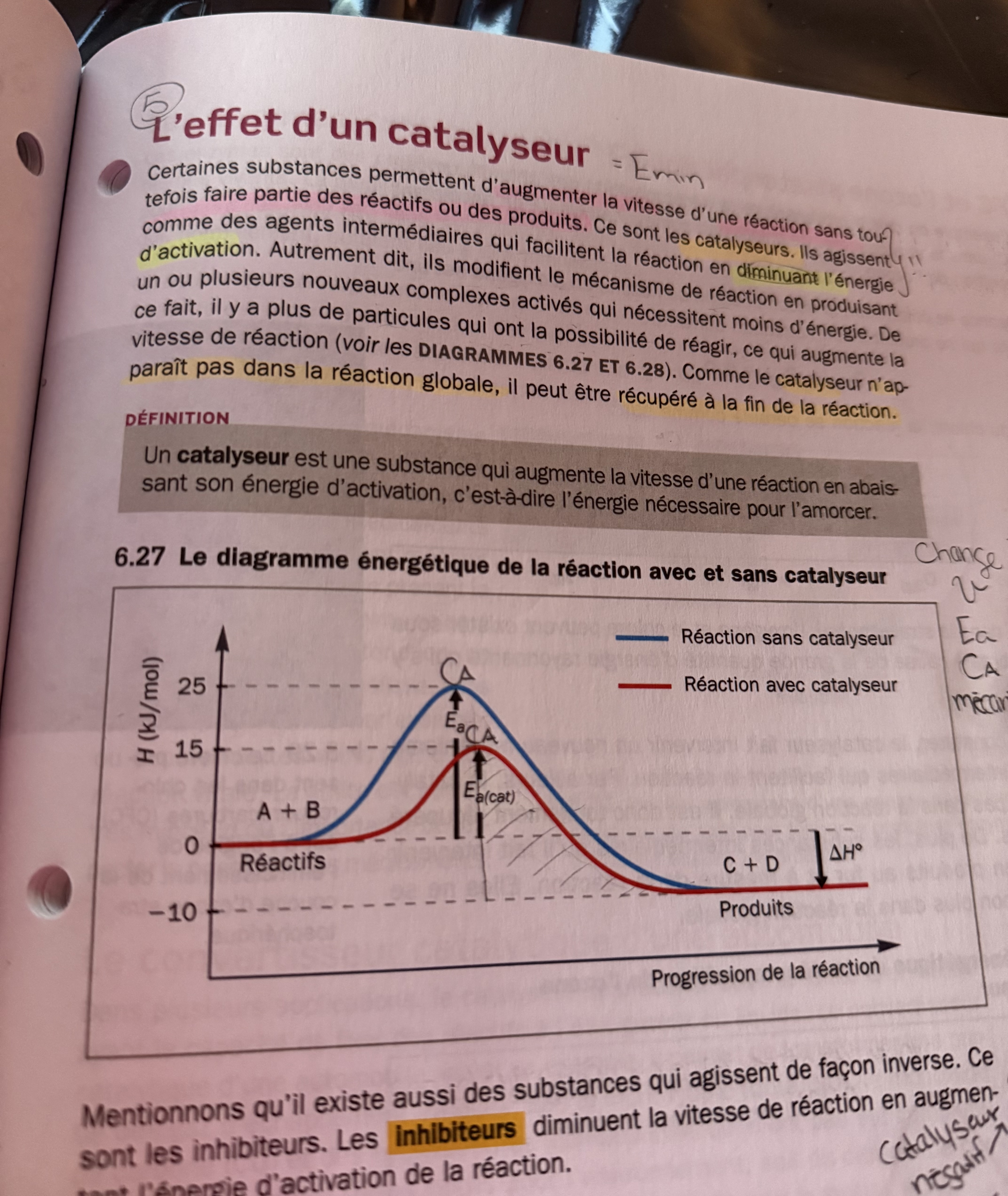
Secondaire 5 • 27jDans ce graphique ,j’arrive pas à comprendre comment on fait pour savoir si la vitesse de réaction augmente?
J’ai compris que normalement avec un catalyseur la réaction augmente, mais dans ce graphique, ça augmente augmente pas
Merci!
-
Vérifiée par Alloprof
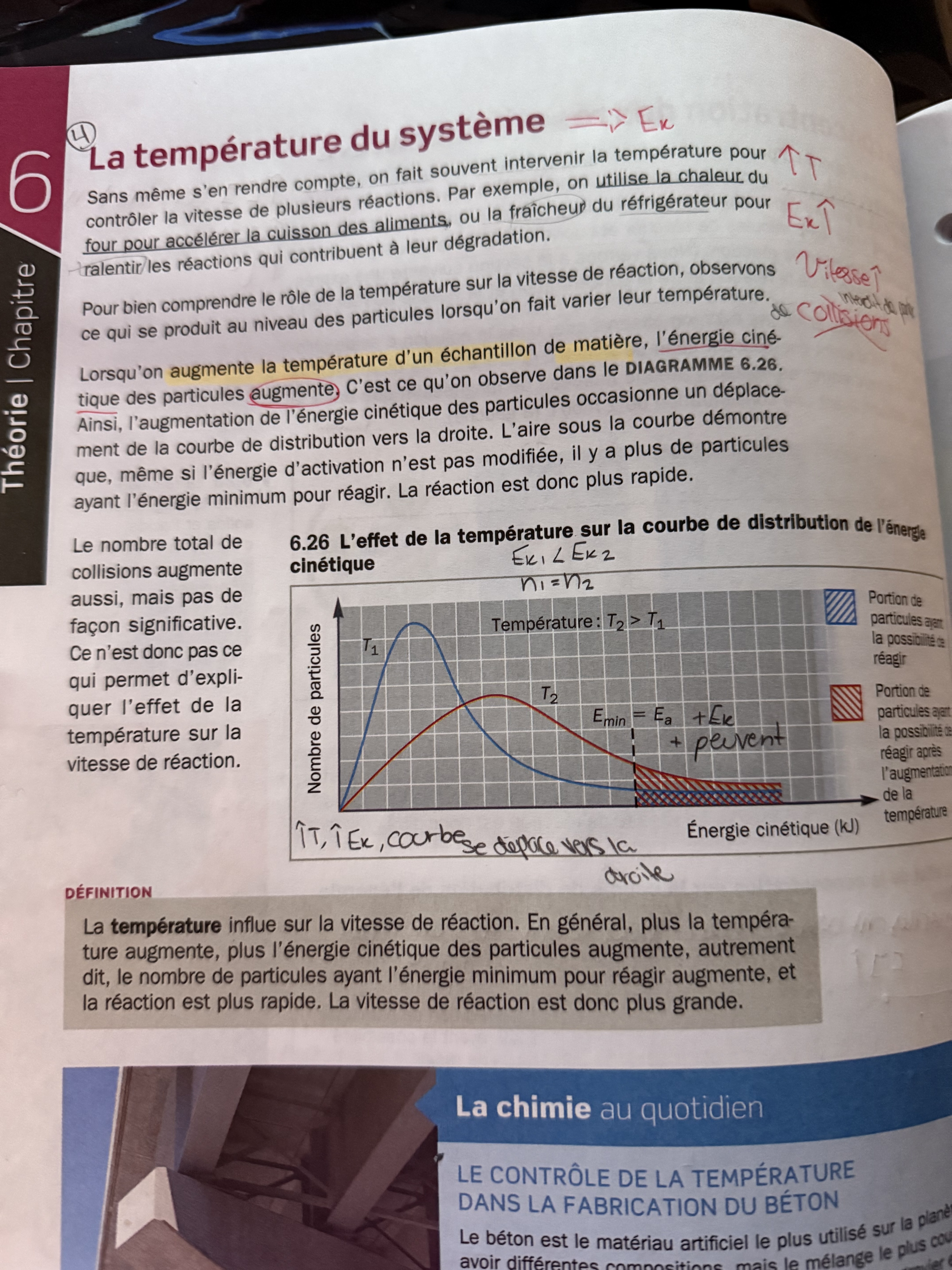
Secondaire 5 • 27jBonjour,j’aurais besoin de l’aide à comprendre le graphique en lien avec la température
Merci!