Secondaire 5 • 2a
Est-ce que quelqu’un peut m’expliquer comment trouver le réactif limitant et le réactif en excès en démarche plus détaillée, car j’ai de la difficulté par rapport aux calculs de proportions stœchiométriques pour les trouver, il y a trop de moles, ce qui me mélange.
Voici le problème: « Si on fait réagir 18,1g de NH3 avec 90,4g de CuO, quel est le réactif limitant? Quelle est la masse du composé en excès? »
merci beaucoup
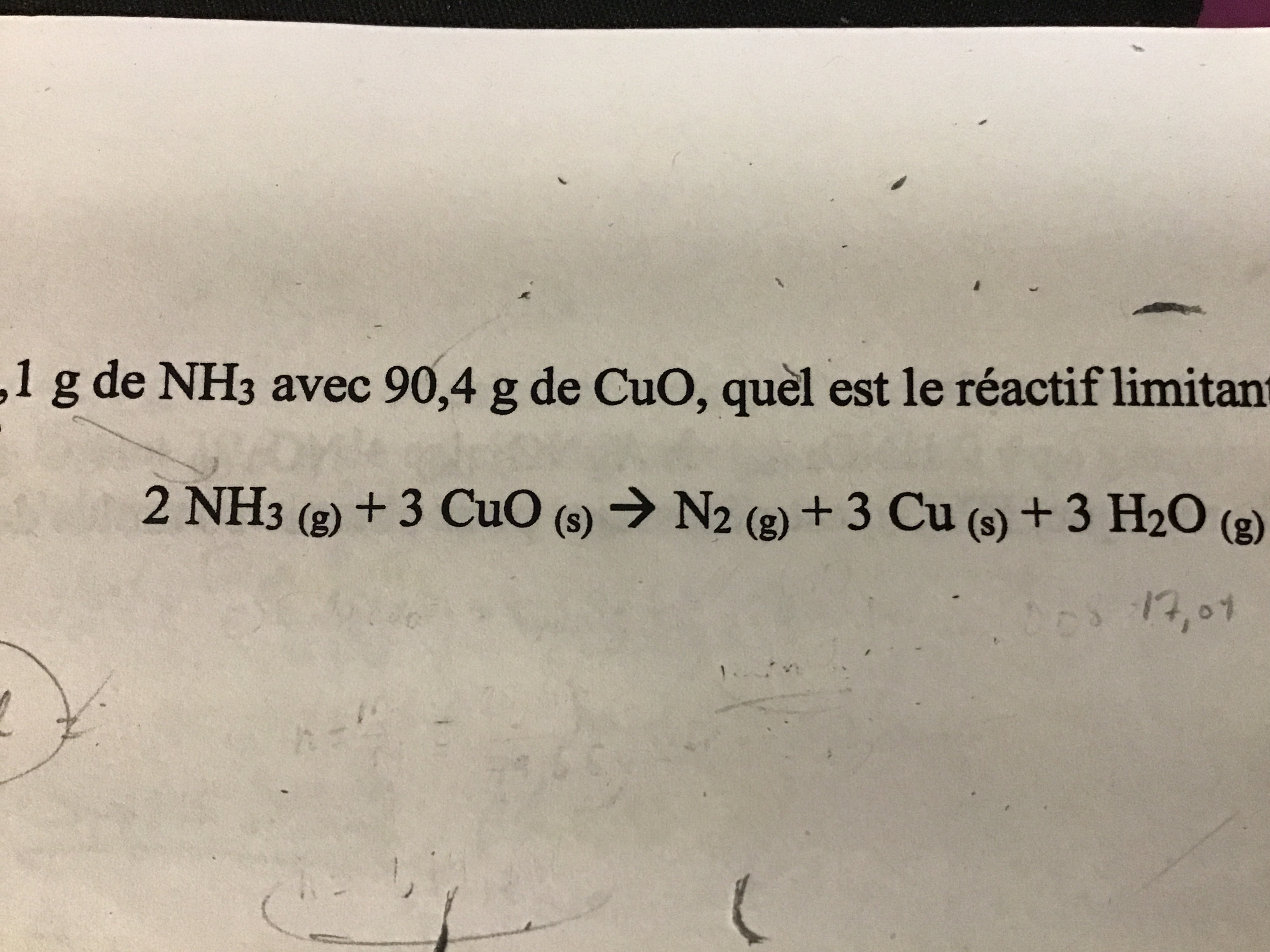






Explication d'Alloprof
Cette explication a été donnée par un membre de l'équipe d'Alloprof.
Bonjour Jupiter Rose!
Merci de faire appel à nos services 😉
Le réactif limitant est celui qui sera complètement consommé. Pour déterminer le réactif limitant, il faut comparer le nombre de moles de chaque réactif avec les coefficients de l'équation balancée.
Dans ton exercice, nous savons qu'il y a 1,5 moles de CuO pour une mole de \( NH_3 \). Tu peux déterminer le rapport de quantité à l'aide des masses fournies. S'il y a moins que 1,5 moles de CuO pour une mole de \( NH_3 \), alors le CuO est le réactif limitant! S'il y a plus de 1,5 moles de CuO pour une mole de \( NH_3 \), alors le \(NH_3 \) sera limitant.
J'espère que cela t'aidera!
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!