Secondaire 5 • 26j
Bonsoir!
Je ne comprends pas pourquoi l'énergie cinétique et la vitesse ne peuvent pas dépendre de la pression de façon que, lorsque la pression augmente, le Ek et V augmentent aussi???
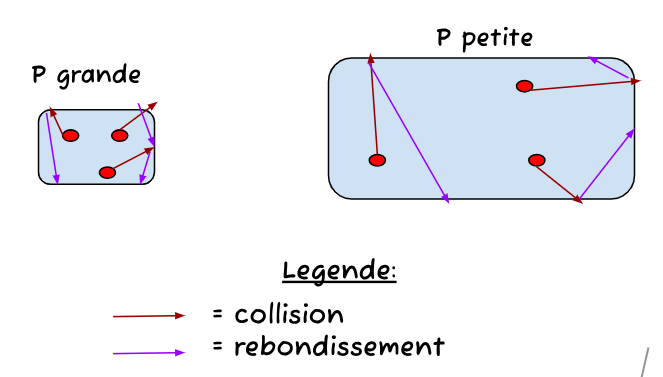
En fait, avec une plus grande pression, on peut se visualiser une boîte davantage petite. Alors, quand j'y visualise des particules en mouvements, l'espace restreint mène à un plus grand nombre de collisions et aussi une vitesse augmenté non, étant donné que les collisions et rebondissements sont plus fréquentes?
Voici ma perception (inconfirmé):
Je suis vraiment confuse!






Explication d'Alloprof
Cette explication a été donnée par un membre de l'équipe d'Alloprof.
Merci pour ta question!
En fait, tu as raison que les collisions avec les parois d'un contenant augmentent lorsqu'un réduit son volume, ce qui fait en sorte que la pression augmente.
Par contre, l'énergie cinétique et la vitesse ne changent pas! En effet, puisqu'on ne peut pas créer d'énergie de cette manière, car les particules n'absorbent pas d'énergie lorsqu'on change le volume, la vitesse et l'énergie cinétique ne changent pas.
On pourrait penser que les particules vont plus vite en les regardant à l'œil nu, mais c'est seulement, car elles ont une plus petite distance à parcourir en moyenne avant de frapper une paroi.
Cette fiche du site d'Alloprof explique la théorie cinétique des gaz :
N'hésite pas si tu as d'autres questions!
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!