Liste de discussions
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour,
comment on sait quelle réaction (directe ou inverse) va être favorisé lors d'une augmentation de pression sans avoir le nb de moles de chaques substances?
Merci.
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour,
- Est ce que cela:Lorsque l'on augmente la température, la réaction à l'équilibre tend à s'opposer à cette augmentation d'énergie.Une augmentation de température déplace l'équilibre en favorisant la réaction endothermique.
- Une diminution de température déplace l'équilibre en favorisant la réaction exothermique.
veut dire que la réaction endo favorise la formation des produits et l'exo la formation des réactifs?
Merci.
-
Vérifiée par Alloprof
Secondaire 1 • 7mmanipulation balace éléctronique durant le labo en science
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour je comprends pas pourquoi j’ai pas la bonne démarche
-
Vérifiée par Alloprof
Primaire 5 • 7mcomment jouer a Reaction solidaire?
-
Vérifiée par Alloprof
Secondaire 5 • 7mJai besoin daide pour le b) je suis pas trop sur si cest endothermique car je trouve que cest peut etre exothermique puisuqe l'augmentation de température a fait diminuer la valeur de K. Cela veut dire que la concentration des produits a diminué. Et on sait que c'est la réaction endothermique qui est favorisée par une augmentation de température. La réaction endothermique est la réaction inverse. Alors, la réaction directe est exothermique
Je suis vraiment confus pouvez vous m'aider?
-
Vérifiée par Alloprof
Secondaire 5 • 7mMa question concerne la constante d’équilibre Kc. Que signifie les concentrations à l’équilibre dans I V E? Je comprends bien que la variation est proportionnelle aux coefficients stœchiométries, mais à l’équilibre, pourquoi les concentrations ne sont plus proportionnelles aux coefficients ? Je me suis dit c’est probablement parce que l’équilibre favorise les produits ou les réactifs, mais ce que j’observe n’est pas concluant avec cette hypothèse . Parfois, la Kc est vraiment supérieure à 1 et ce sont les réactifs à l’équilibre
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonsoir, AlloProf,
Pourquoi est-ce que ces deux substances sont amphotères?
Merci!
-RequinAuthentique849
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonsoir, AlloProf,
Pourquoi, dans ce numéro, on ne peut pas dire que le NH3 réagit avec le HCL?Merci!
-RequinAuthentique849
-
Vérifiée par Alloprof
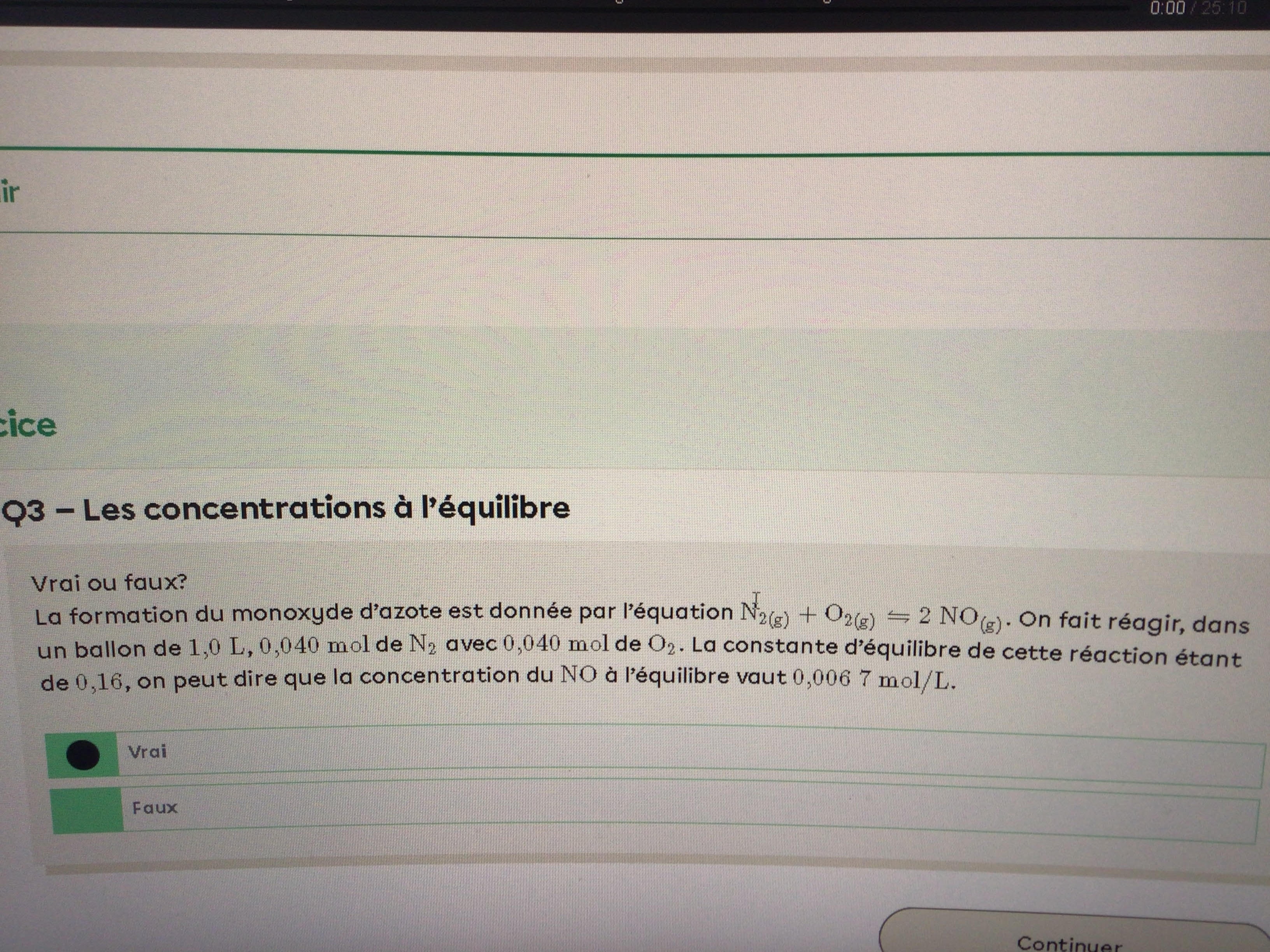
Secondaire 5 • 7mBonsoir, Alloprof,
Dans ce numero, pourquoi la concentration est de 0,0067 mol/L et non 0,0134 mol/L. Selon le tableau, la valeur du produit a l'equilibre est de 2x et si x= 0,0067 mol/L, la concentration du [NO] serait de 0,0134 mol/L.Merci!
-RequinAuthentique849
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonsoir, AlloProf
Pour la constante de basicité et acidité, est-ce que les concentrations ,lors d’une dissociation électrique, des produits sonttoujoursla même? Si oui, pourquoi?
Ex.: Kb= [B+] [OH-]/ [B] où [B+] = [OH-]
Ka= [H+] [A-]/ [HA] où [H+] = [A-]
Merci!
-RequinAuthentique840
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour!! J’ai vraiment pas compris le numéro 5 et besoin d’aide :(
-
Vérifiée par Alloprof
Secondaire 5 • 7mEst-ce que quelqu’un peut aider avec 7,8 et 9 jai vraiment pas compris svp!! (demarche et EXPLICATION sera très utile😞🫶)
-
Vérifiée par Alloprof
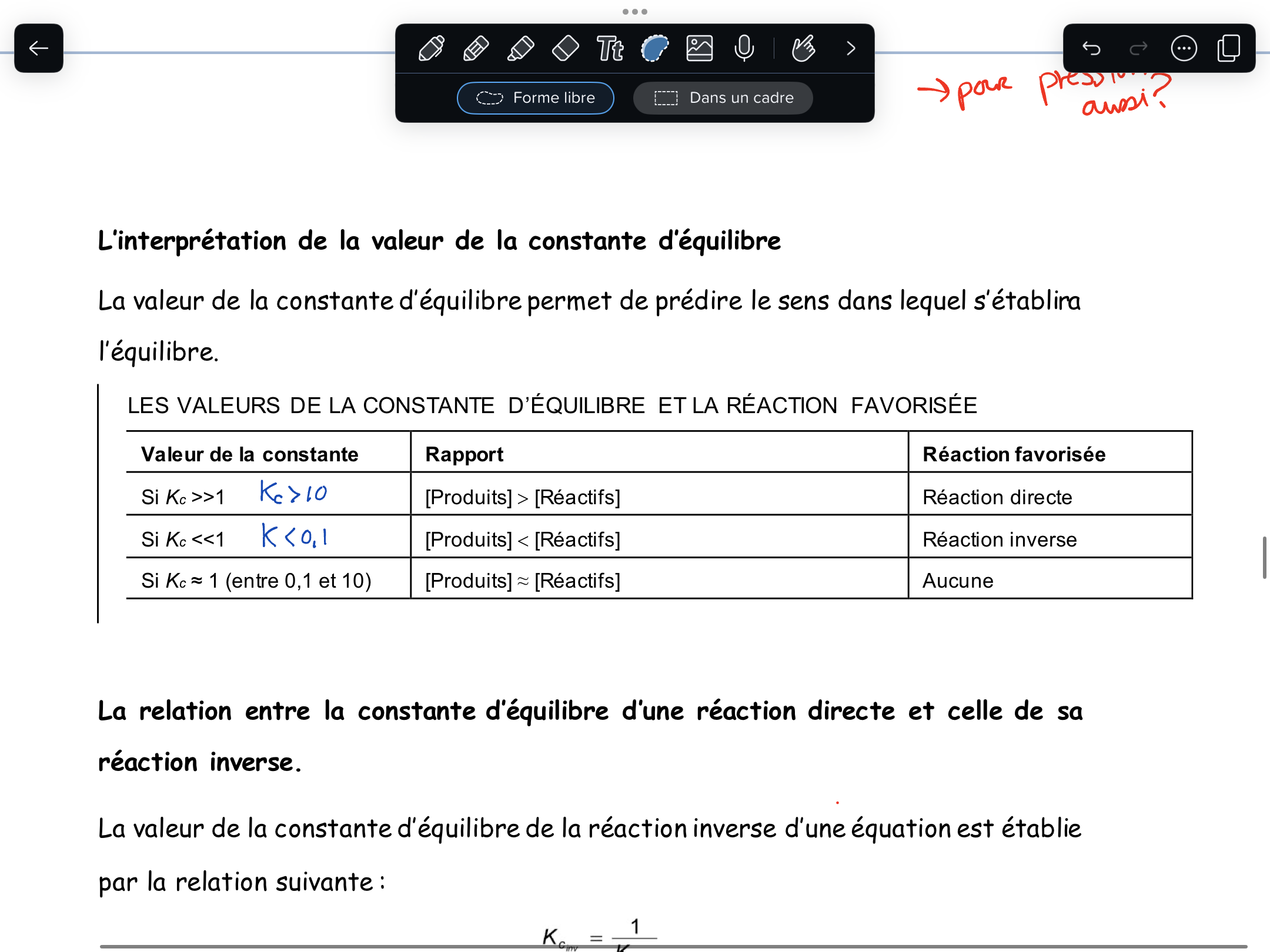
Secondaire 5 • 7mBonjour! J’avais quelques questions rapides sur le chapitre de la constante d’équilibre:
-est ce que cela s’applique aussi pour la constante des pressions partielles? (La section d’interprétation de la valeur)-Je n’ai pas compris pourquoi la constante d’équilibre ne dépend uniquement de la température. Il n’y a pas les facteurs du chatelier qui peuvent l’influencer aussi (comme la pression, le changement d’une concentration, etc.)?
-Est-ce que la valeur de la constante d’ionisation d’eau (1 x 10^-14) possède une unité (ex: mol/L)?
Merci beaucoup!
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour! J’ai fait ce problème, mais lorsque j’essaie de valider mes concentrations à l’équilibre en calculant la constante d’équilibre, ça ne me donne pas 2,5 x 10^4. Est-ce que j’ai fais une erreur à quelque part? Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 7mcomment on fait numero 3 et 5 avec explication et demarche de chaque etape ☹️🙏
-
Vérifiée par Alloprof
Secondaire 4 • 7mBonsoir!
Pourriez vous m'expliquer le lien entre la conductibilité électrique/les électrolytes et le pH svp?
-
Vérifiée par Alloprof
Secondaire 5 • 7mMais est ce que je peux mettre
HA ---> <---- H+ + A -
Si oui, HA est (aq) ou (s) ?
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour, j'ai changer mon no. 2 maintenant je trouve que mon numéro 4 n'est plus bon , car je parle des ions h+ et non de h3o+ donc qu'est-ce ce je dois changer dans le 4. Pouvez vous me dire svp ?
-
Vérifiée par Alloprof
Primaire 5 • 7mAllo!
Dans résction solitsire, y a-t-il une limite de temps? Car ça na m'a pas mis mon temps quand j'ai fini(15min).
PoissonRapide7685
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour,
J'essaie de comprendre la neutralisation acidobasique mais j'ai beaucoup de difficulté. En secondaire 4, j'avais tout compris et maintenant qu'on parle de transfert de protons H+, je suis toute perdue. Comment je peut savoir quel réactif se comporte comme une base et lequel se comporte comme une acide? Par exemple: NH3 + H20
ou sinon avec: HCl + H20
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 7mAllo pouvez vous m'aider pour cette exercise, je suis entrain d'étudier pour mon examen finale de chimie mais j'arrive pas à répondre, je sais pas si le 2 est bien fait, ou bien si c'est plutôt
HA+H2O ---><--- H3O+ A
Car sinon est ce que je dois même refaire le 3. Et 4 . ?
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour,
J'aurai besoin d'aide pour comprendre la décomposition de l'hydrolyse du peroxyde, H₂O₂.
Sauriez-vous capable de m'expliquer comment l'ajout d'un acide, HCl ou d'une base, NaOH influence sa décomposition, svp?
Ce que je ne comprends pas, c'est vraiment les réactions intermédiaires formées, avec ce catalyseur.
Est-ce que pour avoir la réaction globale de décomposition de H₂O₂, il faut que le H₂O₂ doit se trouver dans la première étape de la réaction intermédiaire?
Merci beaucoup
-
Vérifiée par Alloprof
Secondaire 5 • 7mbonjour,
est-ce-que lorsqu'une réaction est à l'équilibre, ca veut nécessairement dire qu'il y a une réaction réversible?
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour,
est ce que c'est bien l'équation thermochimique de la dissolution du kCl? KCl(s)→K(aq)++Cl(aq)−ΔH>0
Merci.
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour,
disons que j'ai une neutralisation entre le NaHCO3 et le CH3COOH, mon enseignante exige que je le fasse avec la formule Q=Q mais comment je fais? Est ce que je le fais avec l'eau? Est ce que j'additionne les masses des deux substances?
Merci.
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour,
est que la neutralisation entre le NaHc03 et le CH3C00H est exothermique ?
Merci.
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour,
si j'ai 50 ml d'une subtance A et 50 ml d'un substance B, comment je peux trouver le Q de cette neutralisation?
Merci.
-
Vérifiée par Alloprof
Secondaire 5 • 7mBonjour,
Est-ce qu'une dissolution est toujours endotherminque et une neutralisation toujours exothermique?
Merci.
-
Vérifiée par Alloprof
Primaire 4 • 7mAvez vous une vidéo qui explique Réaction solitaire?