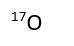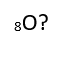Liste de discussions
-
Postsecondaire • 2a
Bonsoir,
...
OrAutonome2754
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonsoir Alloprof! Pourquoi le nombre total de collision d'une réaction Durant laquelle nous avons utilisé un catalyseur n'augmente pas sachant que la vitesse, elle augmente? Si la vitesse augmente, c'est qu'il y a plus de collisions efficaces alors pourquoi le catalyseur n'augmente pas le nombre total de collisions?
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonsoir Alloprof! Comment puis je remplir le tableau Concentration du méthane en fonction du temps dans l'image suivante avec les infos dans le texte. Comment je fais pour trouver la vitesse des produits par rapport au temps avec la donnée 0,067ppm? J'ai visionné vos vidéos sur les ppm mais je sais toujours pas comment résoudre ce problème.
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour!
...
-
Vérifiée par Alloprof
Secondaire 5 • 2aJe fais un laboratoire en lien avec la chaleur de dissolution d'un soluté (un qui absorbe de l'énergie) en fonction du volume d'un solvant (eau). Premièrement, on se demande si le soluté et sa masse sont toujours les mêmes et qu'on ne fait changer que le volume du solvant, est-ce que la température finale de cette solution sera la même à 10 mL d'eau qu'à 20 mL d'eau?
...
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2aDans un laboratoire de calorimétrie, nous devons augmenter le volume du solvant et déterminer quel sera la chaleur finale de dissolution . Mais si on augmente le volume du solvant est-ce que la chaleur finale du soluté va augmenter aussi?
-
Vérifiée par Alloprof
Secondaire 5 • 2asalut
...
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour ,
...
DE MANIERE THEORIQUE , à l' aide des équations partielles suivantes :1.KCl(s) → KCl(aq)
2. KOH(aq) + HCl(aq) → H2O(l) + KCl(aq)
Merciii
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour!
...
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour,
...
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 2aC'est quoi le changement dans l'enthalpie de formation quand une molecule est solide et aqueuse? Par exemple, l'enthalpie standards de formation du KOH (s) est de -424,8 kJ/mol, mais lorsqu'elle est aqueuse est-ce que c'est la meme chose et comment s'ecrit l'equation de sa formation a l'état aqueuse?
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour! J’ai de la difficulté à résoudre ce problème. Je ne comprends pas les démarches à faire pour trouver la masse molaire de la poudre inconnu. Le problème est le suivant, de la poudre inconnu réagit avec de l’acide et la poudre dégage du dioxyde de carbone. Je sais donc qu’il s’agit d’un carbonate. J’ai 3 choix, le carbonate de sodium, le carbonate de potassium et le bicarbonate de sodium. Je dois alors identifier la poudre, je connais ma pression et ma température, puis j’ai plusieurs données de la masse de la poudre et le nombre de millilitres de gaz résultant de la réaction. Pouvez-vous m’aider à régler ce problème et m’expliquer les démarches suivantes svp.
-
Vérifiée par Alloprof
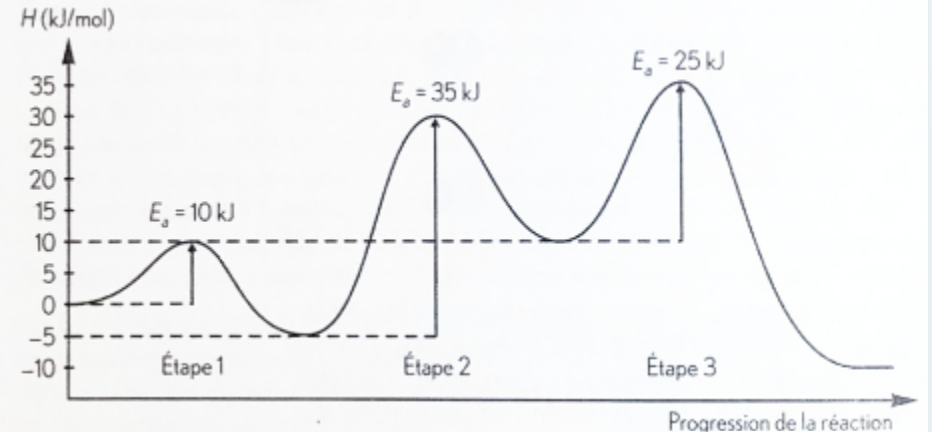
Secondaire 5 • 2aBonjour !
...
Quelle est l'étape déterminante dans ce cas-ci ? L'étape 2 ou 3 ? Je ne suis pas sûre…Merci beaucoup !
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour!
...
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour,
...
J’ai un tableau de données à réaliser, mais je ne sais pas quoi mettre comme titre. Je dois inclure la masse de l’iode, sa masse molaire et son nombre de mol, mais je ne peux pas me répéter dans le titre.
Alors, mon titre ne peut être « masse, masse molaire ainsi que le nombre de mol d’iode ».
J’ai le même problème pour mon tableau sur les informations liées au titrage (volume, concentration, indicateur et moyenne).
Avez-vous des suggestions de titre pour mes tableaux?
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2aJ'aimerais savoir combien d'unités donnent le cours de chimie SVP :)
-
Vérifiée par Alloprof
Postsecondaire • 2aBonsoir, j'ai exercice en chimie de solution et je ne comprends pas pourquoi ma réponse est fausse
...
Vous avez une solution aqueuse de Ca(NO3)2 ayant une molalité de 3,84 mol/kg et une masse volumique de 1,1593 g/mL.
Calculez la concentration molaire volumique (mol/L) de cette solution.Note : La masse volumique de l’eau pure est de 1,000 g/mL.Donnez une réponse avec deux décimales.Voici ce que j'ai fait
Puisque la concentration molaire volumique est en mol/L, j'assume que nous avons 1159.3g par litre de solution
Avec la molalité je sais que j'ai 3.84 mol/1000g de solution. Dans 1159.3g j'ai alors 4.45 moles par litre de solution.
J'ai validé mais je ne comprends pas pourquoi ce n'est pas bon
-
Vérifiée par Alloprof
Secondaire 5 • 2aComment on fait les équations de formation
-
Vérifiée par Alloprof
Secondaire 5 • 2aJ’aimerais comprendre la lois de Hess je ne la comprend pas vraiment.
-
Vérifiée par Alloprof
Secondaire 5 • 2arebonjour
...
-
Vérifiée par Alloprof
Primaire 5 • 2aJe n’ai pas compris cette exercices:Merci d’avance!!!!!!!!!!!n :)
-
Vérifiée par Alloprof
Secondaire 5 • 2abonjour
...
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour,
...
Merci en avance,
TortueDynamique1064
P.S.: nous travaillons avec le volume de chimie Quantum, de secondaire 5.
-
Vérifiée par Alloprof
Secondaire 5 • 2abonjour j’espère vous allez bien
...
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour alloprof,
...
-
Vérifiée par Alloprof
Secondaire 5 • 2aEst-ce que c’est possible d’avoir un pourcentage d’écart négatif entre les valeurs théoriques et expérimentales?
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour, est-ce que c'est normal que ma pente change selon les points que j'utilise dans mon graphique?
-
Vérifiée par Alloprof
Secondaire 5 • 2aEst-ce qu'un atome seul est obligatoirement un ion ? Par exemple : H ou O ou C qui ne sont pas liés à d'autres atomes ? Parce que chaque atome individuel a une charge, sauf ceux dans la famille des gaz rares je crois. J'ai beaucoup de difficultés à comprendre tout le concept des charges, surtout en ce qui concerne les ions polyatomiques.
-
Vérifiée par Alloprof
Postsecondaire • 2aBonjour, je ne comprends pas comment faire:
...
Réponse donnée par le prof: 1.5 mol/kg
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour, je dois faire un rapport de laboratoire et je doit calculer la production de 10 L de dihydrogène avec de HCl à 0,5 mol/L , 1 mol/L et 2 mol/L mais je sais pas comment le faire et je sais pas si je dois utiliser les mol produits par seconde ou les ml par seconde