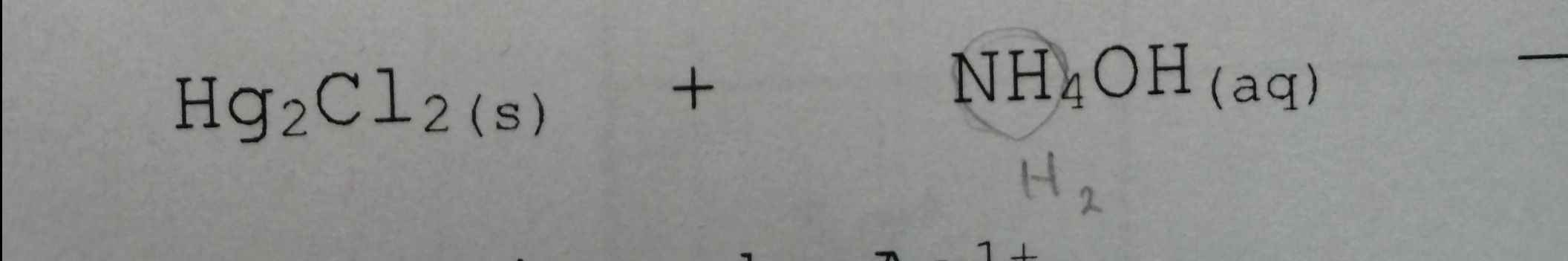Liste de discussions
-
Vérifiée par Alloprof
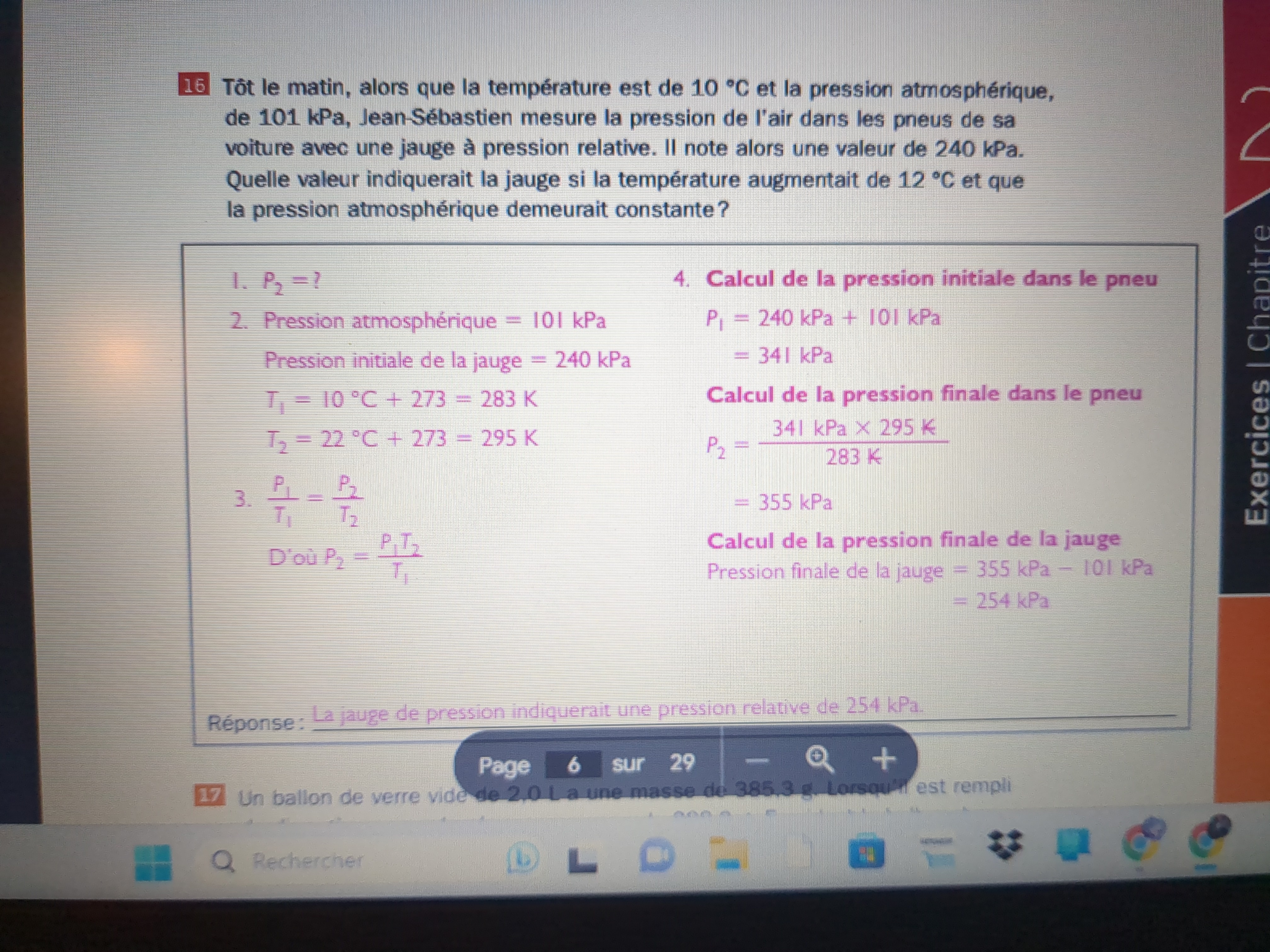
Secondaire 5 • 2aBonsoir,
Je ne comprends pas pourquoi on a additionner la pression atmosphérique avec la valeur de 240 kPa et pourquoi à la fin on l'a soustrait. Merci
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonsoir,
Je ne comprends pas pourquoi on a additionner 101,3 KPa. Même si j'ai noté l'explication, je ne comprends toujours pas.
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 2aUne bouteille scellée contenant un mélange de gaz possède un volume de 500 mL. Sa pression interne est de 121,8 kPa et sa température est de 22 °C. On lance cette bouteille dans un incinérateur, un dispositif servant à brûler des échets.
Si la bouteille demeure intacte après quelques minutes et que sa température interne atteint celle de l'incinérateur, soit 878 °C, quelle sera la pression exercée sur les parois internes de la bouteille ? Exprimez la réponse en kPa.
-
Vérifiée par Alloprof
Secondaire 5 • 2acomment calculer le pourcentage d'écart?
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour, dans mon exercise, mon résultat (la masse molaire) était pas suffisant pour déterminer la nature de mon gaz donc qu'est ce que je pourrais faire pour assurer la nature de mon gaz? merci!!
-
Vérifiée par Alloprof
Secondaire 5 • 2aPourquoi a-t-on appris les lois simples si la grosse formule P1V1/n1T1=P2V2/n2T2 nous donne toutes les formules qu'il nous faut en une seule?
-
Vérifiée par Alloprof
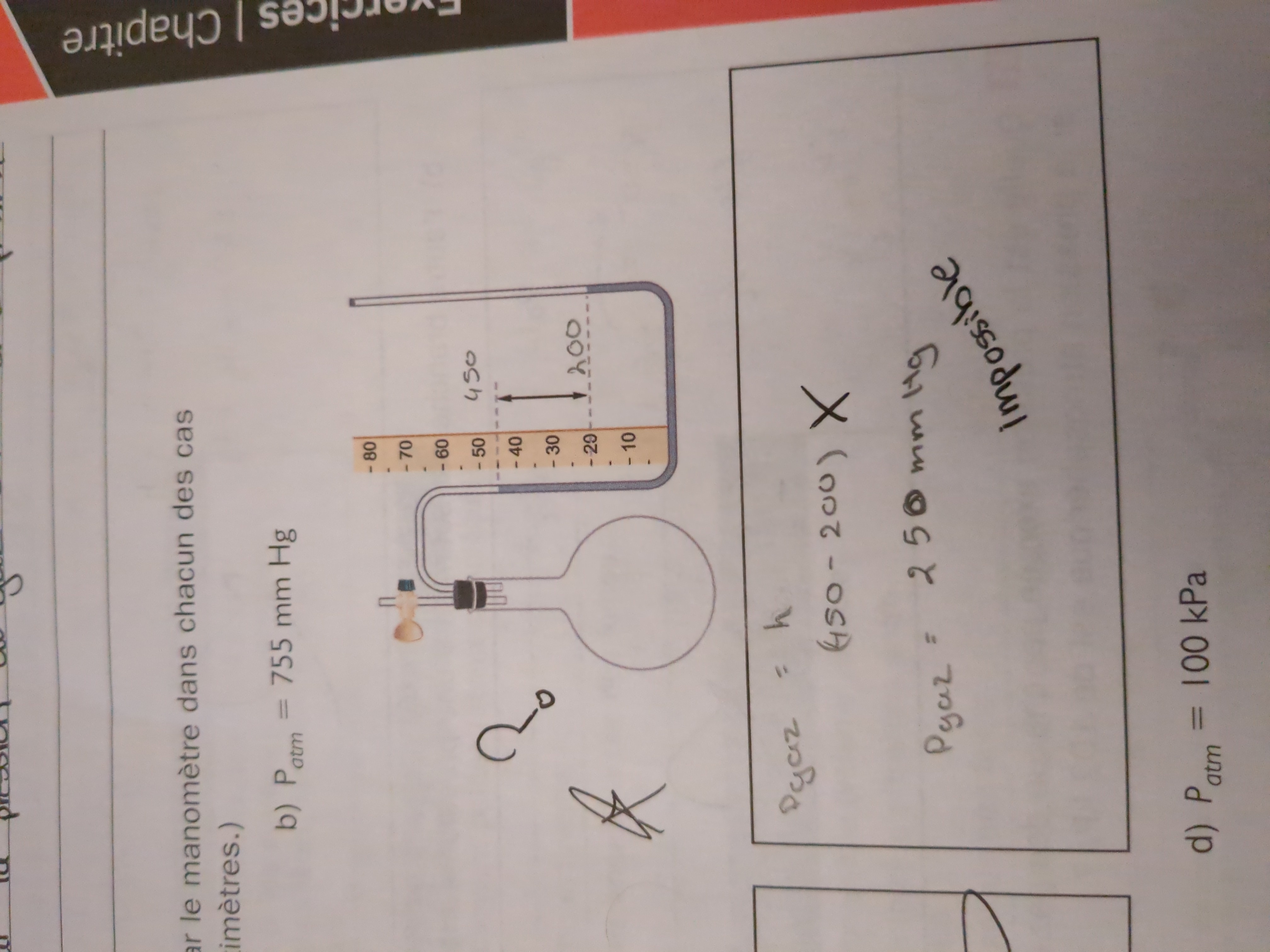
Secondaire 5 • 2aBonsoir,Je ne comprends pas mon erreur. Dans le corrigé, c'est marqué que c'est impossible puisque la pression du gaz sera négatif. Mais je ne comprends pas comment ils ont trouvé une réponse négatif.
Merci
-
Vérifiée par Alloprof
Postsecondaire • 2aBonsoir,
Est-ce que le pourcentage de dissociation correspond à la (quantité de réactif qui a réagi / la quantité de réactif initial) x 100?
Merci et bonne soirée! ;)
OrAutonome2754
-
Vérifiée par Alloprof
Postsecondaire • 2aBonsoir,
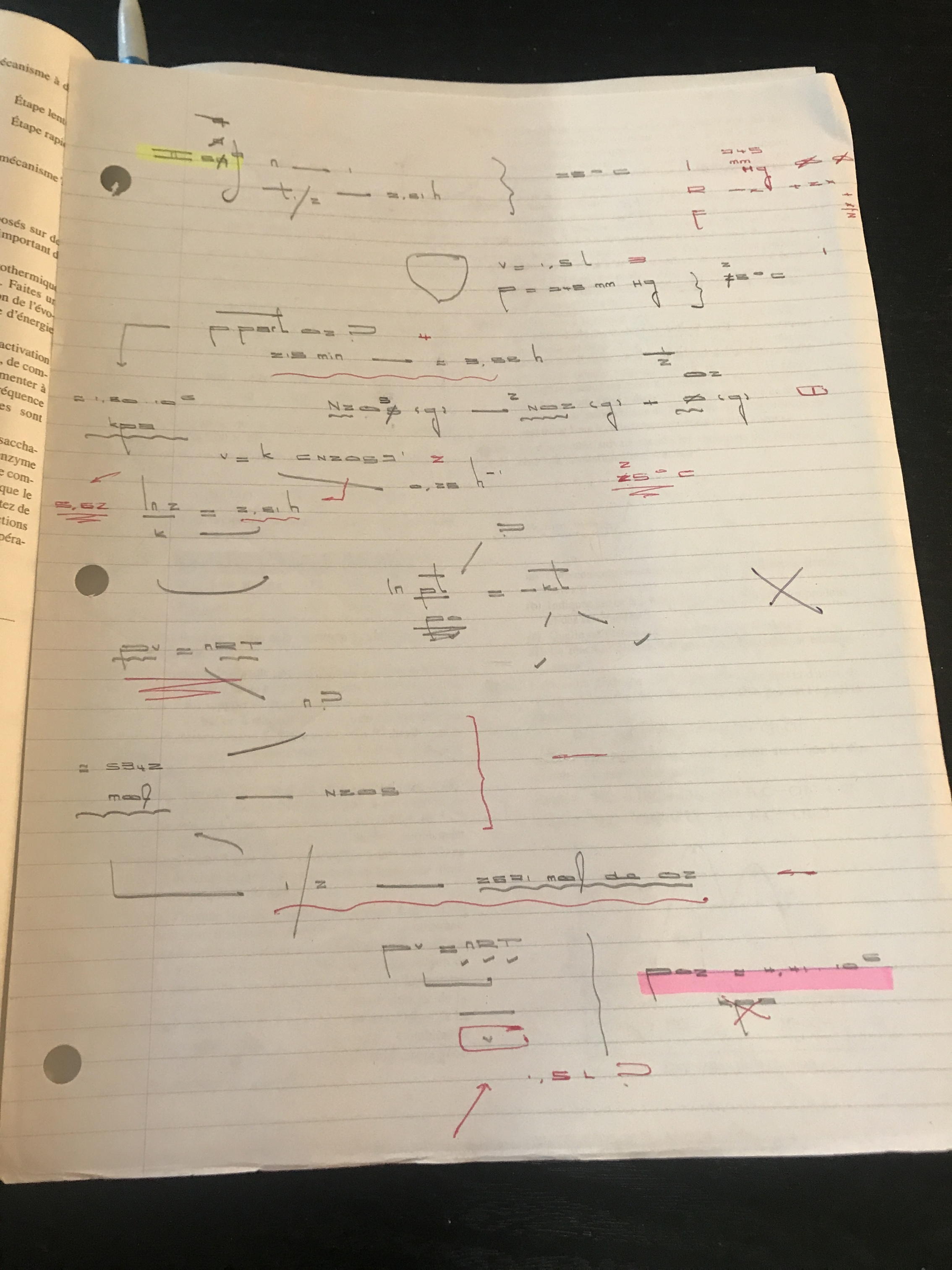
J’aurais besoin d’aide avec cette question : les anthropologues peuvent estimer l’âge d’un os ou d’une autre substance organique par sa teneur en carbone 14, laquelle est constante dans un organisme vivant. Après la mort de cet organisme, le carbone 14 se désintègre avec une cinétique d’ordre 1 et une demi-vie de 5730 ans. Supposons qu’un os humain ancien renferme 19,5% de la quantité de carbone 14 que l’on retrouve dans des organismes vivants. Quel est l’âge de cet os?
Voici ma démarche :Merci et bonne soirée! ;)
OrAutonome2754
-
Vérifiée par Alloprof
Postsecondaire • 2aBonsoir,
J’aurais besoin d’aide avec le numéro 59.Voici ma démarche :Merci et bonne soirée! ;)
OrAutonome2754
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour Alloprof!
Je ne sais pas quels sont les produits de cette réaction:
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour,
Je dois trouver le volume molaire du dihydrogène par déplacement d'eau. Pour trouver le nombre de moles à l'aide de la formule PV=nRT, ayant la pression atmosphérique et celle de la vapeur d'eau, est-ce que je dois utiliser la loi de Daltan pour trouver le bon P et ensuite trouver le nombre de moles?
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2aComment déterminer la valeur constante des gaz parfaits dans diverses unités?
-
Vérifiée par Alloprof
Postsecondaire • 2aBonjour, je ne sais pas si je peux poser cette question car c’est de la matière d cegep, mais j’ai cette question:Et cela me donne 2,4. Pourtant les états e sont pas supposé être des nombres entiers? La réponse est 2.
merci!
-
Vérifiée par Alloprof
Postsecondaire • 2aBonjour!
Je ne sais pas où trouver une référence fiable pour répondre a cette question: Quelle est la couleur de la longueur d’onde d’absorption maximale?
De plus, pourquoi mesure-t-on l’absorbance des solutions à la valeur du max de la substance utilisée et non à une autre longueur d’onde?
-
Vérifiée par Alloprof
Secondaire 5 • 2aQu'est-ce qu'un isomère en chimie?
-
Vérifiée par Alloprof
Secondaire 5 • 2aJe ne comprends pas comment résoudre cette question:On utilise une poudre de Mg(NO3)2 qui se décompose pour gonfler un coussin gonflable. Sachant que le coussin gonflé a un volume de 7.2 litres et doit avoir une pression interne de 163 kPa à une température de 13°C, quel masse de poudre doit-on se décomposer selon la réaction non balancée suivante ? Mg(NO3)²(s)=MgO(s) +N2O(g)+O2(g).
-
Vérifiée par Alloprof
Secondaire 5 • 2aEst-ce que p dans pv=nrt représente la pression de l'atmosphère ou du gaz?
Je dois trouver la masse molaire du dihydrogène par déplacement d'eau. Je connais le nombre de moles, il me reste à calculer le volume. Je connais le volume mais je sais que le volume trouvé correspond à celui de la vapeur d'eau + le dihydrogène. Donc pour trouver le volume du dihydrogène uniquement, est-ce qu'il faut que je trouve la pression du gaz?
Merci d'avance!
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour je ne sais pas la prochaine étape à faire pour trouver la masse de poudre. Voici ce que j’ai fait à date.
-
Vérifiée par Alloprof
Secondaire 4 • 2aC'est quoi le filtrage manuel.
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour, j’aurais besoin d’aide je ne sais pas si je l’ai fais correctement
-
Vérifiée par Alloprof
Secondaire 4 • 2aC'est quoi l'anothe
-
Vérifiée par Alloprof
Secondaire 4 • 2aPourquoi v (h2)=2×v(o2)
-
Vérifiée par Alloprof
Secondaire 4 • 2aPourquoi vh2 est le double de vo2
-
Vérifiée par Alloprof
Secondaire 4 • 2aPourquoi vh2 est le double de vo2
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour , je suis entrain de voir les chiffres significatif en chimie et j’ai du faire l’addition suivante : 500+11. Le prof a donner la réponse suivante: 500. Mais pourquoi?
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour! J'aurais une question par rapport à la chaleur molaire de la neutralisation d'une base solide. Ma question est la suivante:
Quelle est la différence entre la chaleur molaire de neutralisation avec une base en solution aqueuse et la chaleur de la réaction avec une base solide?
Merci!
-
Vérifiée par Alloprof
Secondaire 4 • 2aQui a créé la formule vh2<dfa
-
Vérifiée par Alloprof
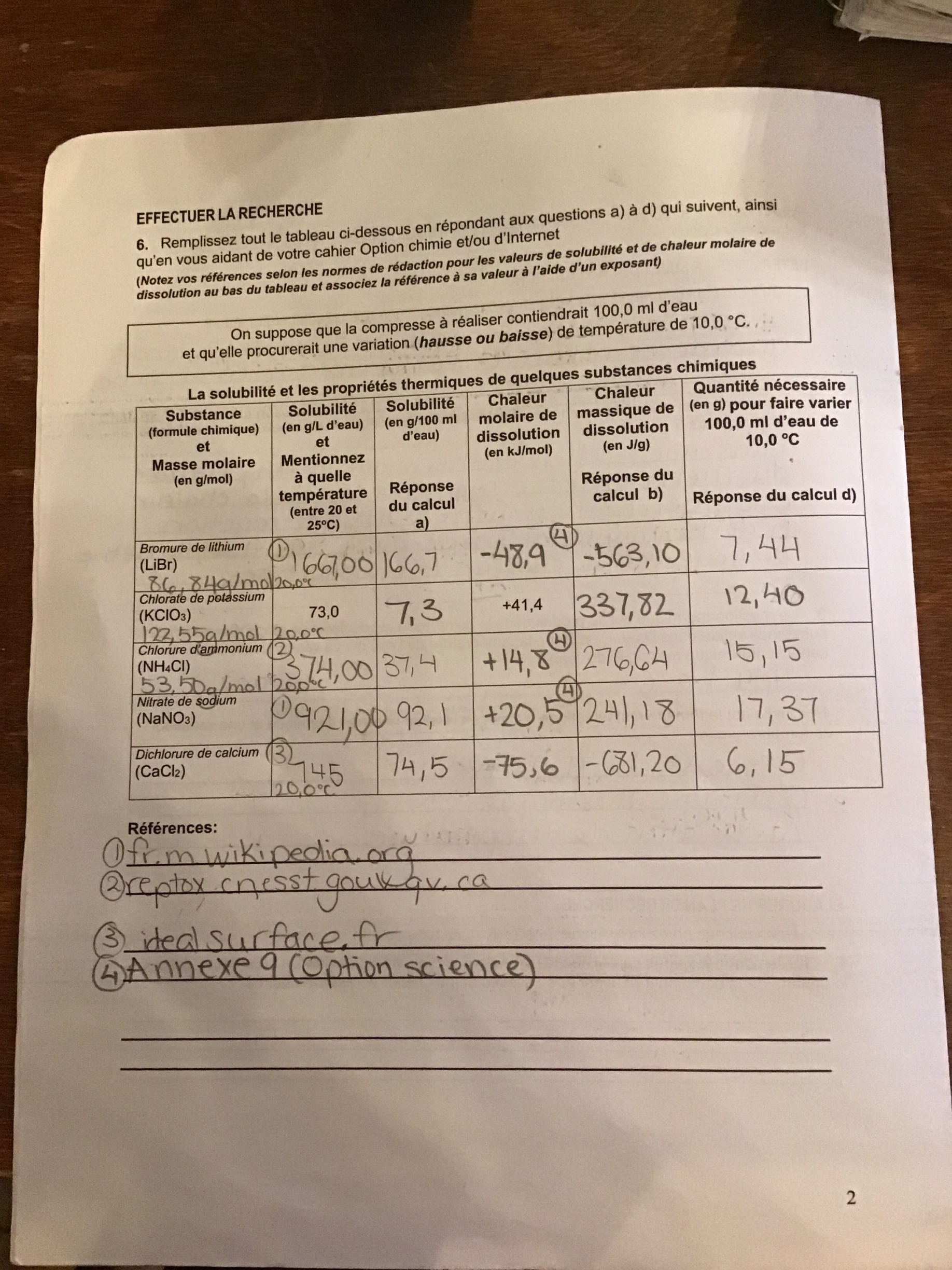
Secondaire 5 • 2aJe ne sais pas quoi répondre à la question 7, aucune des substances ne semblent vraiment se démarqué assez d’une autre pour expliquer qu’elle ne serait pas appropriée? Qu’est-ce que vous en pensez?
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour, est ce que ca existe des thermomètres gradués en kelvins? Merci!