Liste de discussions
-
Vérifiée par Alloprof
Secondaire 5 • 2mQuelle est le syntaxe de la fusion avec de potassiums et de l'or?
-
Vérifiée par Alloprof
Secondaire 5 • 2mComment calculer l'incertitude d'une valeur qui n'en a pas multiplier par une valeur avec une incertitude?
-
Vérifiée par Alloprof
Secondaire 5 • 2mJe ne comprend pas le numéro b)
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonsoir, je ne comprends pas cet exercice. Est ce que vous avec une thevnique pour ce gebre de probleme 8 et 9 .Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2mJe ne sais pas comment écrire l’équation traduit de la combustion de l’octane liquide, C8H18. Pouvez-vous m’aider? Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonjour! Pour mon programme de science, on a un projet qui nous demande de faire une métamorphose botanique pour transformer chimiquement une plante, une herbe, etc. J'ai choisi de faire un thé au saule, qui aurait des particularités similaires à celles de l'aspirine. (acide salycilique) Mon seul problème, c'est que pour tester cela, j'aurais besoin de solution de chlorure ferrique (FeCl), connue pour avoir des caractéristiques corrosives. Je me demandais si, en laboratoire, ce serait possible de contenir cette solution dans une pipette classique de laboratoire sans risque? Merci d'avance!
-
Vérifiée par Alloprof
Postsecondaire • 2mqu'est-ce qui explique la différence entre mon pourcentage de récupération et le rendement idéal dans un laboratoire de recristallisation d'acétanilide? c'est apparement un traitement de donnés en lien avec les formules utilisées. mon pourcentage de récupération est calculé à partir de ma masse purifiée et de ma masse impur de départ. mon rendement idéal est calculé à partir de ma masse récupérable (masse impur initiale - masse soluble à froid) et ma masse impur initial.
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonjour,
Quel est le but et le calcul de “l’erreur expérimentale” svp.
-
Vérifiée par Alloprof
Secondaire 5 • 2mJe comprend pas du tout c'est quoi la théorie cinétique des gaz et ses hypothèses.
-
Vérifiée par Alloprof
Secondaire 2 • 2mComment calculer le nombre d'électrons et de nucleons d'un atome connaissant sa charge et sa masse
-
Vérifiée par Alloprof
Secondaire 5 • 2mc'est quoi l'état plasmatique?
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonjour,
je ne comprend pas comment dessiner un graphique avec la notation scientifique. Est ce qu’utiliser le 2/3 de la feuilles c’est le minimum ou nous devons arrêter le graphique a cet endroit ?
merci !
-
Vérifiée par Alloprof
Secondaire 5 • 2mAllô, quelle est la différence entre la compressibilité et l’expansion en matière des particules de gaz.
je ne comprends pas si quand on parle de compressibilité cela veut dire qu’on rajoute des particules gaz et que si on parle de l’expansion cela veut dire qu’on enlève des particules de gaz ?
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonjour, pour l’énergie cinétique d’un gaz, ça dit que l’énergie cinétique dépend de la masse et de la vitesse. Cependant, une des théorie cinétique des gaz dit que l’énergie cinétique moyenne des particules de gaz dépend de la température. Je ne comprends donc pas est-ce que l’énergie cinétique dépend de la masse, de la vitesse ou bien de la température. Je dois me fier sur quoi pour calculer mon énergie cinétique ?
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonjour, pourquoi dans un des points de la théorie cinétique des gaz, on dit que lorsqu’une particule de gaz rencontre un obstacle, elle rebondit sans perdre de l’énergie, alors que cette théorie dit aussi que quand il y a une collision entre deux particules de gaz, de l’énergie peut être transférée, et une des deux particules va subir un ralentissement et l’autre une accélération. Ceci ne reviendrait-il pas à dire qu’il y a une perte d’énergie pour une des particules ?
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonjour, est-il vrai que pour la diffusion des gaz il y a des collision, mais que pour l’effusion il n’y en a pas
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonjour quelle est la différence entre vaporisation et évaporation
-
Vérifiée par Alloprof
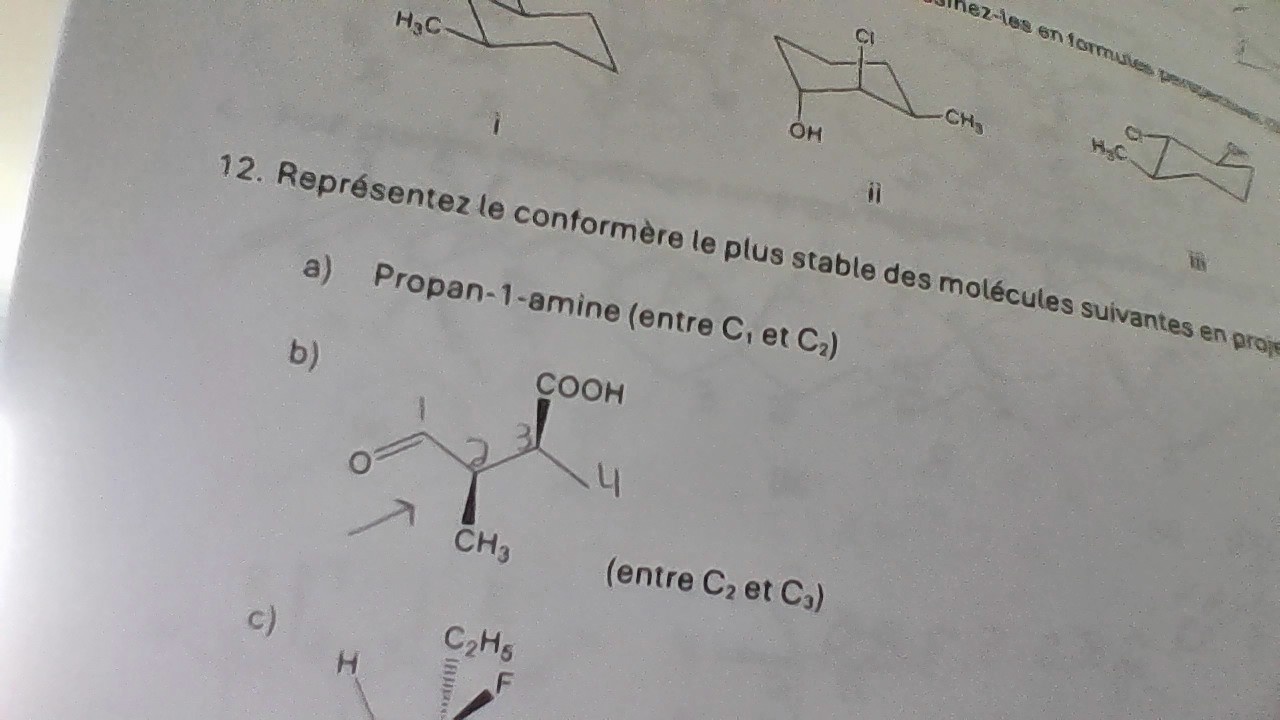
Postsecondaire • 2mBonjour, j'au un problème dans un exercice de chimie. Je doit représenté un conformère de Newman. Je dois numéroté ma chaine. J'ai mit que le carbonne 1 était lui portant la liaison double avec oxygène. Est ce correct ?
-
Vérifiée par Alloprof
Secondaire 5 • 2mAllô pouvez-vous m’expliquer la différence entre l’évaporation et l’ébullition de façon détaillée
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonjour, pouvez-vous m'expliquer de manière détaillée les 3 postulats du modèle particulaire
-
Vérifiée par Alloprof
Postsecondaire • 2mcomment ferait-on pour trouver un nombre de mole de molécules de glucose et la masse d'hydrogène contenus dans un échantillon de 2,50g de glucose
-
Vérifiée par Alloprof
Secondaire 5 • 2mje suis confuse car dans mon corriger la réponse dit que c’est 10,7mL, mais pourtant je pensais que les gaz ayant une masse molaire plus petite se diffusait plus rapidement donc pourquoi là elle est plus lente que le dichlore ?
-
Vérifiée par Alloprof
Secondaire 5 • 2mÀ une température donnée, la vitesse de diffusion du dichlore est de 45mL/min. Trouvez la vitesse de diffusion des atomes d’hélium à cette même température? Pouvez vous me donner la réponse finale s’il vous plaît?
-
Vérifiée par Alloprof
Secondaire 5 • 2mÀ une température donnée, la vitesse de diffusion du dichlore est de 45mL/min. Trouvez la vitesse de diffusion des atomes d’hélium à cette même température ? S’ils vous plait, aidez moi !
-
Vérifiée par Alloprof
Secondaire 5 • 2mLors d'équilibre d'équations chimique avec la méthode algébrique. Quand est ce que peut on considère les ions polyatomique en tant qu'ensemble et pourquoi les consider comme groupe?
-
Vérifiée par Alloprof
Secondaire 3 • 2mC'est quoi l'élément avec le numéro atomique de 87?
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonjour, j'ai une question concernant l'équilibre d'équations chimiques. Lorsqu'on est tenu d'équilibrer une les reactifs et les produits dans une reaction chimique à l'aide de la méthode algébrique, faut t'il decomposer les ions polyatomiques du côté des reactifs et produit également ou peut on simplement les laisser sous leur forme de combinaison d'ion polyatomique? Ou est-ce faux de faire cela, car les ions polyatomique peuvent se décomposer dans les produits et cela ne peut pas toujours respecter les règles du balancement?
Par exemple, si j'ai la réaction avec lion polyatomique du carbonate (CO3): Na2CO3+CaCl2→NaCl+CaCO3
Comment procéder à son équilibre lors de la définition des variables a,b,c et d?
-
Vérifiée par Alloprof
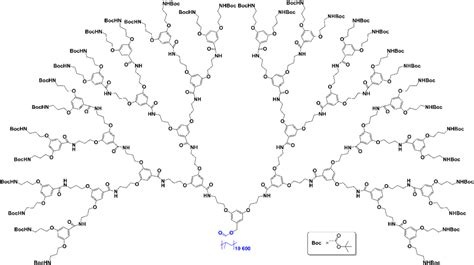
Postsecondaire • 2mC'est quoi cette combinaison chimique?
-
Vérifiée par Alloprof
Secondaire 4 • 2mqu'est ce que l'hydrocarbures?
-
Vérifiée par Alloprof
Secondaire 5 • 2mSi je divise des incertitudes mais que ce n'est pas la même mesure (ex. cm divisé par secondes) ça ne change rien et je dois quand même les additionnés?