Liste de discussions
-
Vérifiée par Alloprof
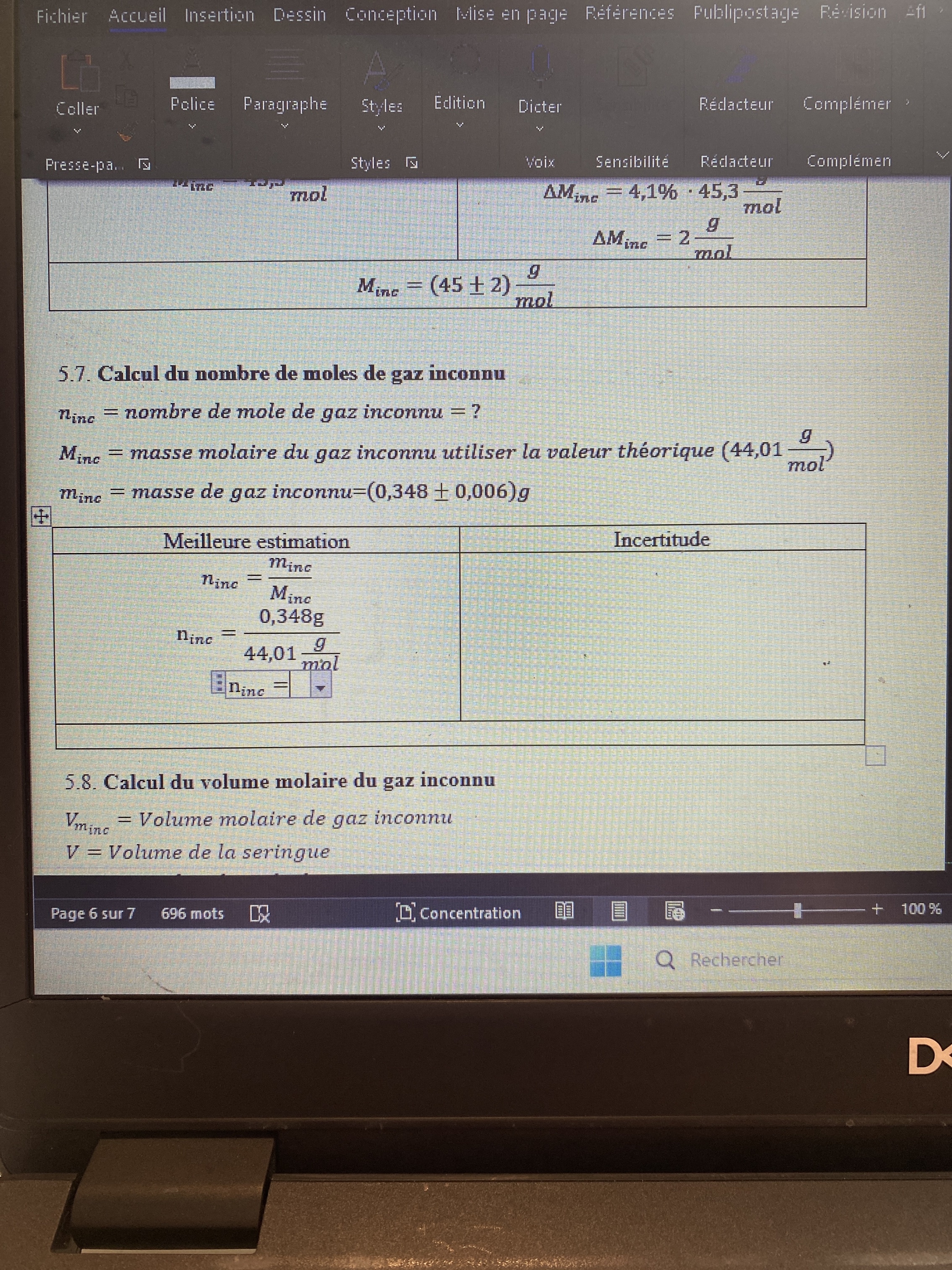
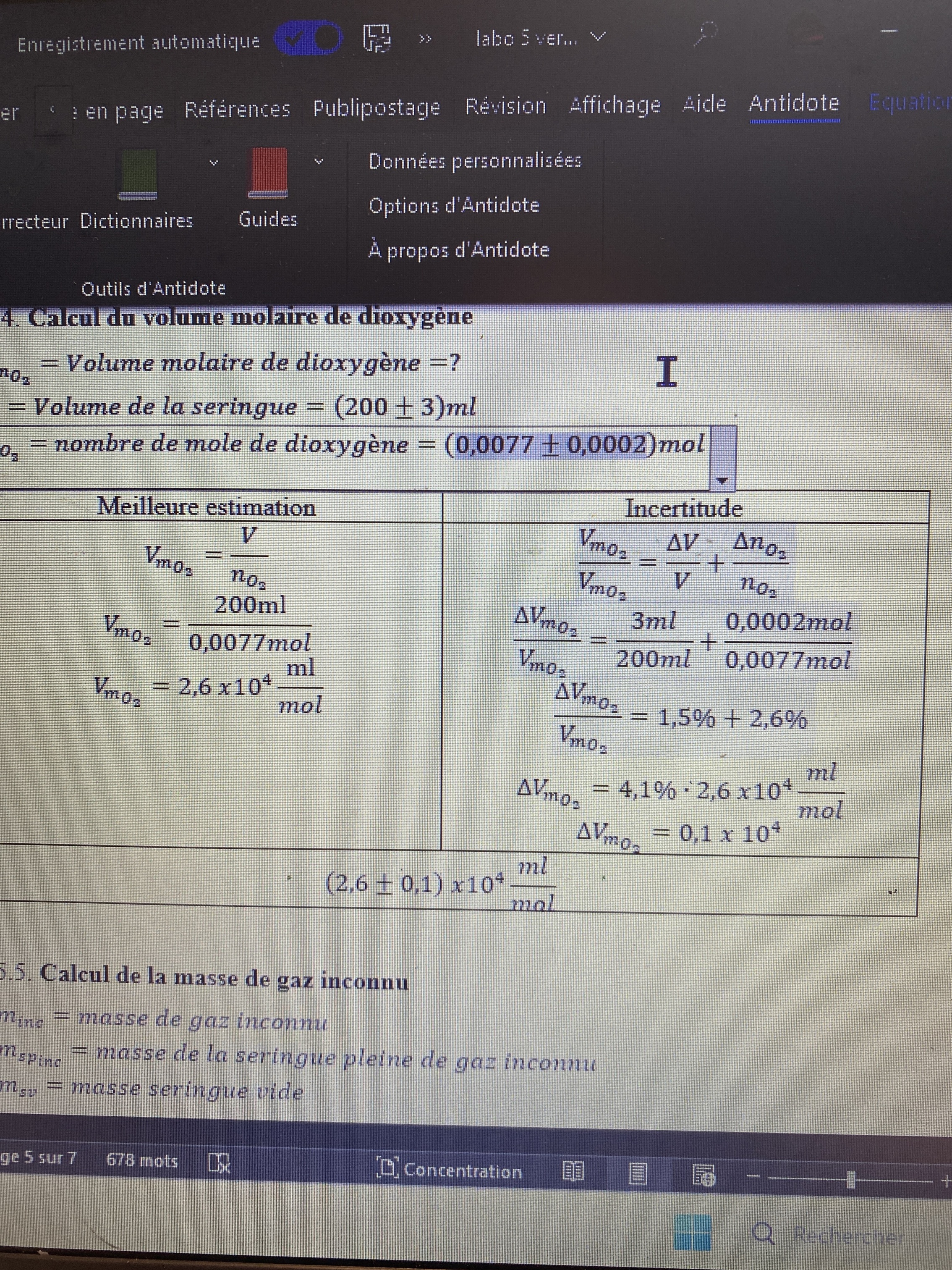
Secondaire 5 • 1mQuel Minc. Dois je utiliser le 44,01 g/mol ( note prof ) ou mon 45+-2 g /mol
-
Vérifiée par Alloprof
Secondaire 5 • 1mEst ce possible ce que j’ai fais
-
Vérifiée par Alloprof
Secondaire 5 • 1mJe ne comprends pas cette question est-ce que quelqu’un pourrait s’il-te plaît me l’expliquer
-
Vérifiée par Alloprof
Secondaire 5 • 1mLorsqu'on effectue la relation entre le volume d'un gaz et la quantité de celui-ci (V/n ou loi d'avogadro), est-ce que la nature du gaz influence cette relation? Par example, si on utilise du diazote ou du dioxyde de carbone, est-ce qu'il y aura une différence entre leur constantes?
-
Vérifiée par Alloprof
Secondaire 5 • 1mje ne comprends pas comment faire ce probleme.
Selon la loi de Hess, quelle est la chaleur molaire de formation de l’éthane (C2H6) dans ce cas-ci?
2 NH3(g) + 2 CO2(g)
C2H6(g) + 2 NO2(g)
-
Vérifiée par Alloprof
Secondaire 5 • 1mBonjour ! Dans l'exercice de la bille d'aluminium dans de l'eau, de la fiche "Les calculs de chaleur", je ne comprends pas comment nous avons supposé, dès le début, que toute l'énergie dégagée par la bille d'aluminium a été absorbée par l'eau. Avec quelles informations devrais-je en arriver à cette conclusion, lors d'un examen par exemple ? Merci :)
-
Vérifiée par Alloprof
Secondaire 5 • 1mEst-ce que quelq'un peu menvoyer quelquechose qui me montre comment faire une conclusion en chimie?
-
Vérifiée par Alloprof
Secondaire 5 • 1mBonjour, afin de réaliser un travail de vulgarisation scientifique, je dois expliquer ce qu'est une protéine substrat et une enzyme pour expliquer le phénomène de bioluminescence. Cependant, je ne trouve pas d'explication claire, alors pourriez-vous m'aider s'il vous plaît?
Merci en avance!
-
Vérifiée par Alloprof
Secondaire 5 • 1mBonsoir,
Dans le cadre de mon laboratoire, je dois inscrire la mesure de chacune de mes données ainsi que l’incertitude associée, comme le montre le tableau ci-dessous :Toutefois, je me demandais quelle pourrait être l’incertitude associée à la mesure d’un papier pH? Est-ce que l’incertitude peut s’appliquer dans le contexte d’une mesure à l’aide d’un papier pH?
Merci et bonne soirée,
LucioleLucide6774
-
Vérifiée par Alloprof
Secondaire 5 • 1mBonjour! Y a t-il une loi simple des gaz qui relie le nombre de mole à la température? Ou cela n'existe pas?
-
Vérifiée par Alloprof
Secondaire 5 • 1mComment faut il trouver les molécules standards à 25°C pour faire des réactions élémentaire dans la loi de Hess?
-
Vérifiée par Alloprof
Secondaire 5 • 1mBonjour je comprends pas ce que je dois faire pour cette question dans mon devoir de chimie (pardon pour la mauvaise qualité d'image)
-
Vérifiée par Alloprof
Primaire 5 • 1mJe ne comprend pas comment trouver les facteurs limitant en chimie secondaire 5
-
Vérifiée par Alloprof
Primaire 5 • 1mpeut tu exploser de quoi des détail
-
Vérifiée par Alloprof
Secondaire 5 • 1mJ’ai de la misère avec ce problème, je sais que la formule est v1/v2= racine carré M2/M1, mais je ne comprends pas comment le faire
-
Vérifiée par Alloprof
Secondaire 5 • 1mComment est ce que je fais la conversion mm Hg -> kPa -> atm avec la logique de 760 mmHg = 101,3 kPa = 1 atm si j’ai une valeur de 78 cm Hg et 1345 pa? Je veut convertir à atm
-
Vérifiée par Alloprof
Secondaire 3 • 1mBonjour,
Je n'ai pas bien compris les PPM, est ce que quelqu'un pourrait m'expliquer s.v.p? L'explication du document n'est pas très claire pour moi...
-
Vérifiée par Alloprof
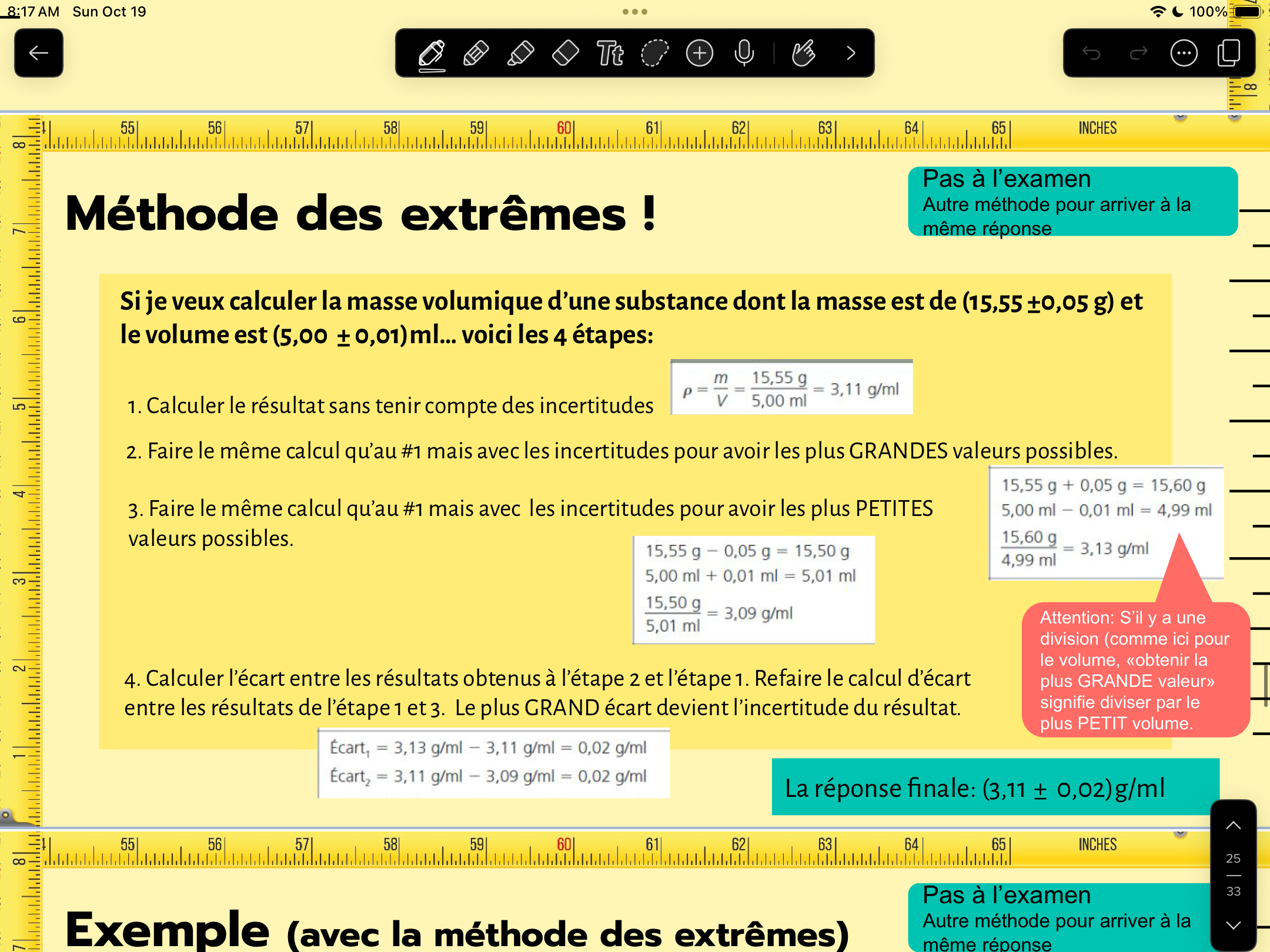
Secondaire 5 • 1mJe ne comprends pas comment faire la méthode des extrêmes pour les incertitudes dans une situation où je fais un produit croisé .Ma prof m’a montré de cette façon.
-
Vérifiée par Alloprof
Secondaire 5 • 1mquelles pourrait etre les nombreuse cause d'erreurs dans un labo de chimie?
-
Vérifiée par Alloprof
Secondaire 5 • 1mAfin de diminuer l'utilisation des énergies fossiles, certaines pompes de station-service mentionnent que l'essence peut contenir une certaine quantité d'éthanol (CH3CH2OH). Quelle est la quantité d'énergie fournie, par gramme de Quelle est la quantité d'énergie fournie, par gramme de CH3CH2OH, lors de la combustion?
2 CH3CH2OH + 6 O2 ---) 4CO2 + 6H2O
Pouvez-vous m'expliquer comment résoudre cette problème? Merci
-
Vérifiée par Alloprof
Secondaire 5 • 1mSi j'ai une solubilité en g/L, pour la convertir en g/100ml, je dois juste faire g/L fois 0,100 pour avoir une solubilité de g/100ml?
-
Vérifiée par Alloprof
Secondaire 5 • 1mBonjour, comment reconnaître la formation d'un précipité dans une image? Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2mComment savoir si les liens d’une équation chimique sont ioniques ou covalents
-
Vérifiée par Alloprof
Secondaire 4 • 2mLe nombre d’electrons sur la 5e et 6e couche de valence
-
Vérifiée par Alloprof
Secondaire 5 • 2mQuelle est le syntaxe de la fusion avec de potassiums et de l'or?
-
Vérifiée par Alloprof
Secondaire 5 • 2mComment calculer l'incertitude d'une valeur qui n'en a pas multiplier par une valeur avec une incertitude?
-
Vérifiée par Alloprof
Secondaire 5 • 2mJe ne comprend pas le numéro b)
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonsoir, je ne comprends pas cet exercice. Est ce que vous avec une thevnique pour ce gebre de probleme 8 et 9 .Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2mJe ne sais pas comment écrire l’équation traduit de la combustion de l’octane liquide, C8H18. Pouvez-vous m’aider? Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2mBonjour! Pour mon programme de science, on a un projet qui nous demande de faire une métamorphose botanique pour transformer chimiquement une plante, une herbe, etc. J'ai choisi de faire un thé au saule, qui aurait des particularités similaires à celles de l'aspirine. (acide salycilique) Mon seul problème, c'est que pour tester cela, j'aurais besoin de solution de chlorure ferrique (FeCl), connue pour avoir des caractéristiques corrosives. Je me demandais si, en laboratoire, ce serait possible de contenir cette solution dans une pipette classique de laboratoire sans risque? Merci d'avance!