Liste de discussions
-
Secondaire 5 • 5m
Bonsoir! Question de m'assurer que je comprend ce concept;
...
J'ai essayé de comprendre cela avec une analogie:
Par exemple, si nous étions dans un terrain de soccer et qu'on jettait des petits poids sur le terrain. Les poids ont une masse, mais par rapport à la taille du stade , leur masse n'influence pas l'espace qu'elles occupent, si on les rapprochait toutes en ensemble, la leur leur taille serait importante (comme pour de très haute pression pour les gaz réels), mais espacées toutes entre elles, elles sont partiquement invisible dans le terrain.
Ainsi, pour les gaz, vu qu'ils se déplacent dans toutes les directions et ne sont pas limité au fond du contenant (comme les poids sur le sol), les particules sont si éparpillé entre elle que le volume ne peut pas être fixe et donc considère qu'elle occupe toute le volume du contenant car elle se retrouve un peu partout dans celui-ci
Est-ce bien cela?
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonsoir! Pourquoi dit-on qu'aux même condition de température et de pression deux volumes égaux de gaz différent occupent le même nombre de particules ?
...
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonsoir, en lien avec cette question:https://www.alloprof.qc.ca/zonedentraide/discussion/110258/questionVoici quelques exemples de ce que je veux dire:
...
2-3-Pourquoi dans le 2e et 3 exemple, on a pas à ajouter de 101,3 kPa pour trouver les pressions demandé si le volume est constant/rigide comme dans l'exercice un? Aurait-il des mot clé/indice qui permettent de savoir quand il faut ajouter 101,3kpa? Merci
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonsoir, je ne comprends pas du tout cette question. Je ne comprends pas le corrigé du prof. Merci et bonne soirée!
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonjour je ne comprends pas tous les numéros. Dans le corriger de mon prof, celui-ci a utilisé des données dont je ne comprends pas l’origine. Savez-vous quelle est la formule utilisée afin de faire ces calculs?
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonjour!
...
Voici les deux buts:
- Déterminer la relation mathématique entre le volume d'un gaz et la quantité d'un gaz lorsque la pression et la température demeurent constantes.
- Déterminer si nature du gaz a une influence sur la relation mathématique entre le volume et la quantité d'un gaz. Merci!
-
Vérifiée par Alloprof
Secondaire 4 • 5mBonjour,je ne comprend pas ce numéros pouvez vous m'aider svp?
-
Vérifiée par Alloprof
Secondaire 5 • 5mbonjour pouvez vous trouver mon erreur et est ce que ma demarche est bonne
-
Vérifiée par Alloprof
Secondaire 5 • 5mEst il impossible de trouver la pression du gaz A?
-
Vérifiée par Alloprof
Secondaire 4 • 5mJ’étudie présentement La concentration molaire des ions H+ et le pH et je n’y comprend absolument rien. Je ne comprend pas comment
...
Ensuite, 0.01 mol de H+ est bien égal à un pH de 1 mais j’aimerais avoir une explication plus profonde à ce sujet.
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 5mJe n’arrive pas à trouver mon erreur et est ce que ma démarche est bonne?
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonjour! En lien avec ceci:https://www.alloprof.qc.ca/zonedentraide/discussion/110218/questionJe ne suis pas sûre de comprendre ce qu'est un réactif limitant, pourriez-vous me l'expliquer? Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonjour! Dans quels types de problèmes qui parle d'un contenant rigide devons nous ajouter 101,3kPa aux pressions? Car, je n'ai a date que trouvé un problème qui avait besoin qu'on ajoute 101,3, mais dans d'autre problèmme qui mentionne contenant rigide, dans le corrigé, on n'ajoute 101,3
...
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonjour! Je n'arrive pas à identifier p1, v1, t1 et p2, v2, t2 dans ce problème..voici un schéma de ce que j'ai compris et mes démarche à datemerci!
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonjour!Dans ce problème, comment peut-il avoir une vartiation du volume si de l'étape 2 à 4, le piston semble être au même endroit et donc le gaz occupant le même volume? Merci
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonjour, en lien avec ceci:https://www.alloprof.qc.ca/zonedentraide/discussion/110212/questionJ'ai fait un schéma de comment je vois le problème, peut-être que cela vous aidera à cibler mieux ce que je n'ai pas compris!Merci!
-
Vérifiée par Alloprof
Secondaire 4 • 5mPourquoi le CO2 ne peux pas être une liason ionique alors que les deux oxigènes à besoin de 4 electrons et que le carbon à exactement 4 electrons. Le carbone pourrais donner tous ces électrons aux oxigènes non ?
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonjour! Je ne comprend pas pourquoi ici
...
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonjour! En lien avec ceci:https://www.alloprof.qc.ca/zonedentraide/discussion/110112/questionJe ne suis pas sûre de comprendre pourquoi si on vide complètement la bouteille, le nombre de mole n'atteindra jamais zéro et que la pression non plus n'atteindra pas zéro.
...
-
Vérifiée par Alloprof
Secondaire 5 • 5mAllo je comprend pas ce problème : À TPN, on introduit 0,050 L d'hélium (He) et 0,075 L de dioxygène (O2) dans un contenant de 150 mL. Quelle est la pression partielle de l'hélium?
...
J'ai absolument aucune idée quoi faire je pense a utiliser
P1/V1 = P2/V2
Donc
Pression He : pression total × Volume helium/volume total
Pression He = 101,3 × 0.05/0.15
Ce qui me donne une pression de 33, 8 kPa donc je croix pas que c'est ça la démarche donc pouvez vous m'aider comme j'ai même utiliser tous les données, cets a dire le dioxygène alors pouvez vous svp m'aider j'ai un examen mercredi et je stress beaucoup
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonjour,
...
-
Vérifiée par Alloprof
Secondaire 5 • 5mJai beosin daide pour ce numero : Un extincteur, dont le volume est de 6,0 L, contient 1,35 kg de dioxyde de carbone gazeux (CO₂). Lorsqu'il est propulsé à l'extérieur de l'extincteur, le gaz se retrouve à une température de 23 °C et une pression de 101,3 kPa. Quel est le volume de gaz échappé de l'extincteur?
...
Est ce qu'il consiste juste de faire 1. Trouver le nombre de moles c'est a dire 1350g ÷ 44.01 g/mol = 30.68 mol
Et après ça
Utilisez la loi des gaz parfaits en faisant
V = nRT/P
V=( 30.68 x 8.314 x 296.15)/101.3
V= 745.3 L
J'ai aucune idée s'il faut faire ça donc Pouvez vous m'aider dans ma démarche
-
Vérifiée par Alloprof
Secondaire 5 • 5mAllo je comprend pas ce problème : À TPN, on introduit 0,050 L d'hélium (He) et 0,075 L de dioxygène (O2) dans un contenant de 150 mL. Quelle est la pression partielle de l'hélium?
...
Ce que j'ai pense a faire est que
Pression He : pression total × Volume helium/volume total
Pression He = 101,3 × 0.05/0.15
Ce qui me donne une pression de 33, 8 kPa donc je croix pas que c'est ça la démarche donc pouvez vous m'aider
-
Vérifiée par Alloprof
Secondaire 4 • 5mComment savoir si je dois écrire des chiffres romains à la fin d'un formule chimique
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonsoir! Je ne comprend pas ceci
...
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonsoir! J'ai de la misère avec ce problème:
...
Dans la résolution fait en classe on a défini nos données ainsi:
V1= 20,0L V2 = 500*1,2L = 600L P1= ? P2= 101.3kPa
Puis quand on resous on obtient P1= 3039kPa. Cependant ensuite on a fait +101,3kPa pour dire que P1= 3140,3 kPa et je ne comprend pas pourquoi...
Pourriez-vous m'aider à comprendre? Merci
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonsoir! Donc, si je comprend bien
...
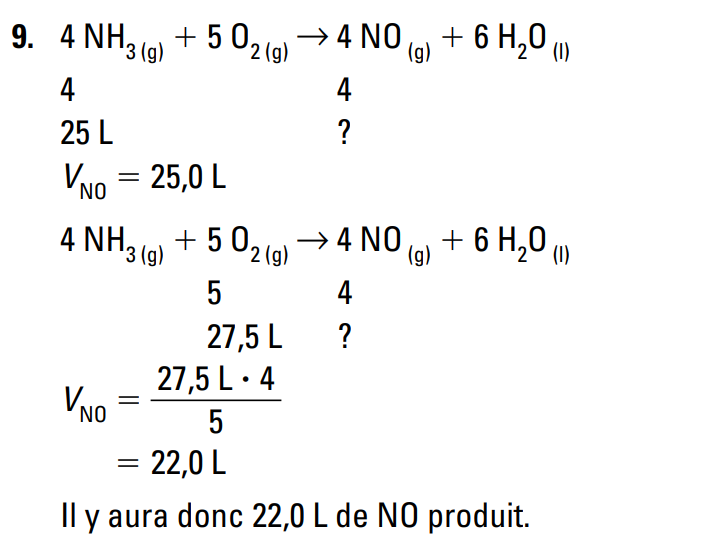
La loi des combinaisons gazeuse justifie la stoechiométrie? Du coup, les coéficient dans une formule balancé indique le nombre de volume d'un certain gaz dont il faut ajouter à un autre volume d'un autre gaz pour obtenir x volume d'un nouveau gaz? Et cette loi stipulaire que les coéfficient ne sont jamais des nombre à virgule et ce sont toujours des volume de nombre entier? Est-ce bien cela? Merci
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonsoir! En lien avec ceci:https://www.alloprof.qc.ca/zonedentraide/discussion/110067/questionJe dois avouer ne toujours pas comprendre comment la pression constante ni comment cette explication va en lien avec l'hypothèse, il me semble qu'il n'y aucune corrélation....
...
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonsoir! En lien avec ceci:https://www.alloprof.qc.ca/zonedentraide/discussion/110066/questionJe dois avouer ne toujours pas comprendre l'utilité d'utiliser / trouver le volume molaire d'un gaz.
...
Si on prend le volume molaire à 24,5 L/mol, si on utilise la formule M=m/n, le n sera de 1? Est-ce bien ça? Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 5mBonsoirNotre enseignante nous avait mentionné que le fait qu'un contenant est rigide est important dans le calcule car il faudrait additionner la pression qui était déjà dans le contenant (101,3kpa) avec le pression finale obtenu par le calcul. Cependant, je ne comprend pas pourquoi on doit faire ça. À moins que j'ai mal entendue, mais trouver p2 nous donne pas directement la pression finale du gaz? Merci