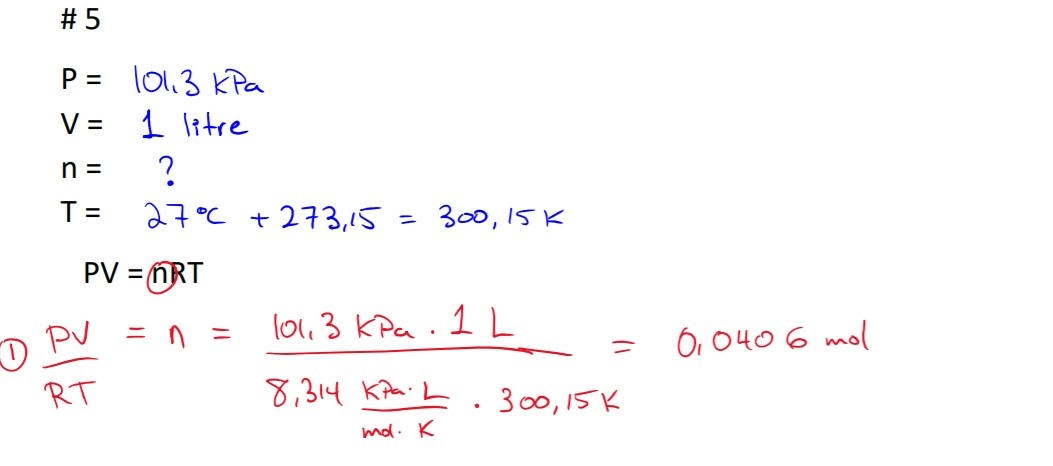Liste de discussions
-
Secondaire 5 • 3a
Bonjour M. Anthony!https://www.alloprof.qc.ca/zonedentraide/discussion/17587/question/p1Quand vous dites plus l'énergie est importante, plus la force d'attraction entre les atomes devient importante, est-ce que l'énergie potentielle devient de la force d'attraction?
...
Si non, pourquoi quand un gaz devient liquide, il y a dégagement d'énergie? Est-ce que c'est l'énergie cinétique qui est dégagé parce que les particules de gaz bougent plus vite que celles du liquide d'une même substance? Mais si c'est le cas, pourquoi dit-on que la réaction chimique est exothermique quand l'énergie potentielle du produit est plus petit que l'Ep des réactifs? Ou est-ce que c'est plutôt un dégagement des deux types d'énergies?
Sinon, merci beaucoup pour l'autre réponse, vous avez vraiment bien expliqué! :D
-
Vérifiée par Alloprof
Secondaire 5 • 3aC'est quoi l'énergie potentielle des liens?
...
-
Vérifiée par Alloprof
Secondaire 5 • 3aJe voudrais savoir comment écrire l’équation chimique et thermique de la synthèse du cyanure d’hydrogène (HCN). Merci beaucoup!
-
Vérifiée par Alloprof
Secondaire 5 • 3a(SUITE À MA QUESTION PRÉCÉDENTE)
...
dans le problème #2, pourquoi il faut utiliser PV= nRT pour trouver le nombre de mol de He? moi, dans ma démarche j'ai utiliser le produit croisé car c'est à température de la pièce, à 25 degré non? pourquoi ma méthode est mauvaise?
merci!"
*** on nous donnait déja le volume du gaz, de 0,5 L alors pouquoi ne peut-on pas faire une produit croisé avec 1mol=24,5 L et x mol=22,4L pour trouver le nombre de mol à TPN?
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, ma question est la suivante:
...
Quand une réaction chimique absorbe de la chaleur d’où cette énergie vient-elle?
Merci en avance!
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour
...
-
Vérifiée par Alloprof
Secondaire 5 • 3aPourquoi à un moment donné, l'énergie potentielle des liaisons chimiques deviennent négative? Qu'est-ce que le "moins" veut dire? D'où est allé cette énergie?
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour,
...
merci!voici ci joint une partie du corrigé.
-
Vérifiée par Alloprof
Secondaire 5 • 3aPour un lab de chimie on me demande l’énergie libérée par la cire. Je crois que l’équation est Q=mcdeltaT mais je ne connais pas le c… merci à l’avance :)
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour!
...
-
Vérifiée par Alloprof
Secondaire 5 • 3aQuelle est la différence entre la variation d'enthalpie et le bilan énergétique? Est-ce qu'ils ont la même valeur?
-
Vérifiée par Alloprof
Secondaire 5 • 3aJ’ai deux réactions avec deux nombre de moles différents. Pourquoi quand il y plus de moles, il y a plus d’énergie?
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour est-ce que quelqu'un peut m'explique comment résoudre ceci étape par étape? Merci d'avance
-
Vérifiée par Alloprof
Secondaire 5 • 3aQuel est le pH d'une solution de Mg(OH)2 de concentration 0,2040 mol/L ?
-
Vérifiée par Alloprof
Secondaire 5 • 3aDéterminez le pH d’une solution basique d’aniline (C6H5NH2) 0,035 mol/L sachant que l’aniline a une constante de basicité Kb égale à 4,0x10-10.
Pour cela vous devez :
- Écrire l’équilibre de dissociation de cette base dans l’eau et donner l’expression Kb.
- Compléter le tableau IRÉ.
- Calculer le pOH.
- En déduire le pH
-
Vérifiée par Alloprof
Secondaire 5 • 3aUn acide faible, HA, de concentration 0,262 mol/L a un pH de 4,00.
Calculez la constante d'acidité, Ka, de cet acide.
-
Vérifiée par Alloprof
Secondaire 5 • 3aQuelle est la concentration d'une solution de KOH dont le pH = 12,4 ?
-
Vérifiée par Alloprof
Secondaire 5 • 3aallo! question de chimie:
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour,
...
-
Vérifiée par Alloprof
Secondaire 5 • 3aquelqu'un pourrait m'aider pour résoudre cette problème ?
-
Vérifiée par Alloprof
Secondaire 5 • 3aQuelles sont les étapes pour résoudre le problème s’il vous plait, je n’y arrive pas. J’ai un examen après demain.
-
Vérifiée par Alloprof
Secondaire 5 • 3aQuelles sont les étapes pour résoudre le a) et le b) svp. J’ai un examen après demain en chimie.
-
Vérifiée par Alloprof
Secondaire 5 • 3aa l'aide du tableau de l'énergie de liaison, calculez approximativement la variation d'enthalpie de :
...
-
Vérifiée par Alloprof
Postsecondaire • 3aBonjour! Je suis perdue dans mon devoir, je ne sais pas par où commencer et les démarches à faire.
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour!
...
parce que si je cherche une pression, la valeur «P» se trouve dans les 3 formules.... c'est mélangeant je sais jamais lequel utiliser
Merci d'avance,
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour,
...
j'ai pensé trouver le nombre de moles de O2 et appliquer la formule générale, mais je ne sais pas s'il faut faire comme ça.Merci.
-
Vérifiée par Alloprof
Secondaire 5 • 3aDans un contenant de 675 mL, à 33°C, on mélange 0,0045 mol de A et 0,0062 mol de B. La réaction suivante se produit :
...
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour,
...
Je voulais savoir pourquoi il est difficile de faire le vide dans une seringue fermée?
Merci.
-
Vérifiée par Alloprof
Secondaire 5 • 3aConsidérons l'équilibre suivant :
2 COF2 (g) ⇆ CO2 (g) + CF4 (g) Kc = 1,96
On introduit 0,372 moles de COF2 dans un contenant de 971 mL à 1000°C.
Quelle sera la concentration molaire de COF2 à l'équilibre ?
(Petit rappel mathématique : A2/ B2 = (A/B)2 )
Donnez votre réponse avec 3 chiffres significatifs et sans noter l'unité.
-
Vérifiée par Alloprof
Secondaire 5 • 3aJe ne comprends pas comment faire ce problème.