Liste de discussions
-
Vérifiée par Alloprof
Secondaire 4 • 3aAllo, je faisait les exercises sur les liasions ioniques et covalentes mais je ne comprenait pas comment determiner la formule chimique. Par exemple, Mg et N devenait Mg3N2. Es ce que quelqu'un pourrait m'aider?
-
Vérifiée par Alloprof
Secondaire 5 • 3abonjour,
Si l'on dissout 1,14 mol de C6H5NH3Cl dans 8,55 L d’eau, quel sera le pH ?
dans l'eau, les ions sont : C6H5NH3+ et CL- et le Cl- est un ion spectateur donc je ne le considere pas. Par contre le C6H5NH3+ est un acide conjugué.
donc l'équation serait
C6H5NH3 + H2O = C6H5NH3+ + OH-
et donc maintenant je dois trouver la qt de OH- pour trouver mon pH. J'ai fait un tableau IVÉ, avec la constante de basicité du C6H5HH2, et ca me donne un pH de 8,858 mais ce n'est pas la bonne réponse.pouvez vous m'aider et m'indiquer la bonne démarche a faire ?
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour! Je me demandais dans le cadre d'un travail en chimie si l'énergie nucléaire était considérée comme une énergie verte ?
Merci beaucoup!
-
Vérifiée par Alloprof
Secondaire 5 • 3aSavez-vous quel type de gaz on utilise pour les cousins gonflables (airbag)?
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour je suis en train de faire des exercices en chimie puis il y a un numéro que je n'arrivais pas à faire donc je suis aller voir dans mon corrigé puis je vois qu'ils ont mit dans le calcul (24,5L) ils ont alors déduit qu'il s'agit d'un exercice de TAPN je ne comprend pas car ni la température ni la pression concorde, pouvez vous me dire pourquoi alors on l'a utiliser?
merci de votre aide
-
Vérifiée par Alloprof
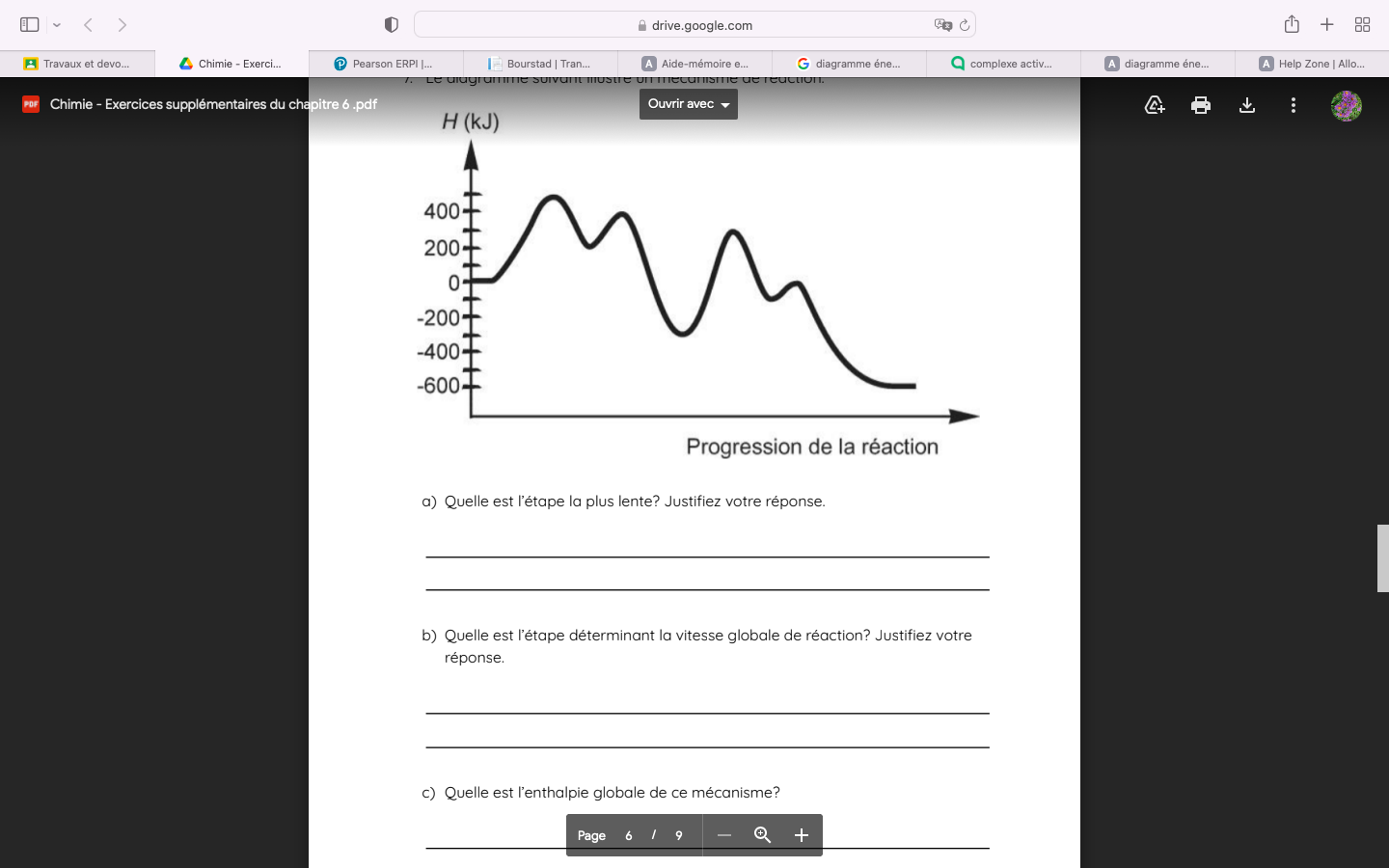
Secondaire 5 • 3aJe ne comprend pas comment déterminer la vitesse globale des réactions et l'enthalpie globale dans ce schéma.
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 3abonjour, je ne sais pas comment trouver la pression partielle initiale ici svp
-
Vérifiée par Alloprof
Postsecondaire • 3aBonjour ,
Comment peut-on- expliquer l'effet endothermique et exothermique lors de la dissolution d'une substance ?
Svp je veux une longue explication c'est pour un tp . Merci bien
-
Vérifiée par Alloprof
Secondaire 5 • 3abonjour,
On mélange les deux solutions suivantes
220 mL de Be(OH)2 0,000681 M et 238 mL de LiOH 0,000675 M
Calculez le pH du mélange
J'ai fait c1v1=c2v2, et ensuite calculer ma concentration OH- pour trouver mon ph (14 - pOH), mais ca me donne pas la bonne reponse pouvez vous maider ?
-
Vérifiée par Alloprof
Secondaire 5 • 3aQuelle est la différence entre un catalyseur positif et négatif? Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 3aPlus il y a de collisions efficaces, plus la vitesse de réaction est rapide ou lente? Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 3aQuelle est la masse de d’oxygène nécessaire pour brûler complètement 1,00kg de butane?
-
Vérifiée par Alloprof
Secondaire 5 • 3aAuriez-vous des sites ou des exercices (avec corrigé) pour que je puisse pratiquer la loi de Hess? Merci :)
-
Vérifiée par Alloprof
Secondaire 5 • 3aC’est quoi le protocole?
-
Vérifiée par Alloprof
Secondaire 5 • 3aSalut, j'ai besoin d'aide est-ce quelqu'un pourrait me dire les étapes à faire pour résoudre ceci? Merci
-
Vérifiée par Alloprof
Postsecondaire • 3aBonjour , qu'elle est la masse d'eau et la concentration d'eau dans 100ml d'eau distillée ?
Merci bien .
-
Vérifiée par Alloprof
Postsecondaire • 3aest ce que la temperature monte ou descend au cours d'une reaction endothermique?
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, pouvez vous m’aider pour la question a et b svp ? J’ai répondu au 1 mais le 2je ne sais pas vraiment pas ce que je devrais répondre…
merci
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, je me demandais si une augmentation de la pression du milieu réactionnel a un effet sur l’équilibre lorsque certains produits ou réactions sont à un état autre que gazeux (solide liquide ou aqueux). Merci d’avance !
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonsoir! Lorsque je révisais pour mon examen de demain en chimie, j'ai remarqué que dans la section sur la chaleur massique et molaire de réaction, il y avait une erreur dans la conversion des données. Le 7542 J reste 7542 même après la conversion en kilojoules, donc je souhaitais juste le souligner pour que vous en faites ce que vous voulez! Merci
-
Vérifiée par Alloprof
Secondaire 5 • 3aComment on trouve la vitesse de réaction juste avec des équations chimiques?
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, j'aimerais que vous m'aidiez sur les lois simples des gaz. J'ai de la difficulté et j'aimerai aussi avoir des exercices sur ça s'il vous plait.
-
Vérifiée par Alloprof
Primaire 5 • 3aVous pouvez m'aider on va faire des bateaux et sa doit résister a les billes mais je ne sais pas si c'est des feuilles de la paille ou des baton de glace
-
Vérifiée par Alloprof
Secondaire 5 • 3aSalut en chimie nous étudiions l’equilibre chimique. Quelqu’un pourrait expliquer ce qui se passe lorsqu’on augmente la température d’un système selon la loi de Le Chatelier?
-
Vérifiée par Alloprof
Postsecondaire • 3aBonjour , je veux une définition de l'enthalpie de dissolution .
Merci bien .
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, j'ai beaucoup de difficulté à comprendre La Lois de Hess et ce malgré les exercices fais en classe. Mon cahier de note n'aide pas non plus.
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour! Dans cette question, je ne comprends pas pourquoi augmenter la surface de contact aurait aucune influence sur la vitesse de la réaction? Est-ce que c’est même possible de faire augmenter la vitesse d’une réaction aqueuse en augmentant la surface de contact? Quelle influence aurait le Pb(NO3)2 solide sur la réaction et pourquoi?
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, je me demandais si quelqu’un pouvait m’aider à résoudre ce problème. J’ai trouvé que la vitesse de la réaction est de : v = 0,0750 [SO2], mais après je ne sais plus quoi faire. Merci d’avance.
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour! Je ne comprends pas le rapport de l’unité de temps dans ce problème. La réponse est le A. Merci!
-
Vérifiée par Alloprof
Postsecondaire • 3aComment différencier un anion d’un cation?