Liste de discussions
-
Vérifiée par Alloprof
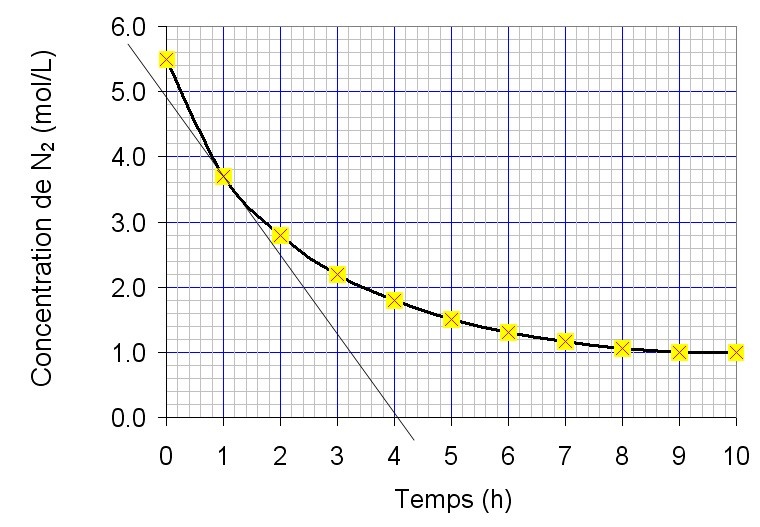
Secondaire 5 • 3aÀ Éveline O : donc si je comprends bien, plus la température est grande, plus la surface de contacte est grande et plus le nombre de collisions est grand, la courbe se déplacera vers la droite, tout en étant plus basse ? Merci encore :)
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, j'aimerais savoir quel sont les liens des facteurs qui influencent la vitesse de réaction avec le graphique de distribution d'énergie ? La question exacte du prof c'est : « Facteurs qui influencent la vitesse de réaction (liens avec graphique distribution d’énergie) » ? Je connais les 5 facteurs, mais je n'ai aucune idée des liens avec la graphique. C'est en Chimie de Sec 5. Merci à l'avance :)
-
Vérifiée par Alloprof
Secondaire 4 • 3aBonjour!
Je ne comprend pas à quoi sert et qu'indique le nombre qui sort d'un bilan énergétique. Aussi, si celui-ci est positif, cela veut-il dire que c'est une réaction endothermique?
-
Vérifiée par Alloprof
Postsecondaire • 3aQuelle est importance des réactions chimiques dans la vie de chaque jour?
-
Vérifiée par Alloprof
Secondaire 4 • 3aBonsoir!
Pour la stœchiométrie, pouvons-nous utiliser la méthode produits croisés entre les réactifs ou ça doit être entre un réactif et un produit?
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, je ne comprend pas pourquoi la température influence la constante d’équilibre d’une réaction. Je comprend que la pression, le volume et la concentration des substances d’une réaction n’ auront aucun effet sur la constante d’équilibre, mais je n’arrive pas à comprendre pourquoi la température elle l’influence. Merci d’avance pour une explication !
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, j'ai lu les pages d'allo prof mais je ne suis pas sur de comprendre la vitesse générale, la formule est vA/nA, mais est-ce que l'on utilise la vitesse instantanée? Si oui, est-ce qu'on utilise le nombre de moles au départ ou au moment mesuré? Si on utilise la vitesse moyenne, quel nombre de moles est ce que l'on prend?
Merci!
-
Vérifiée par Alloprof
Secondaire 4 • 3aBonjour! En ce qui concerne la stœchiométrie, je ne comprends pas comment on pourrais affirmer (pour faire nos calculs) que dans l'équation chimique qui suit: 2 H2O → 2 H2 + 1 O2, que 1 mole de dioxygène donne 2 moles de H2O alors que c'est 1 mole de dioxygène PLUS 2 moles de H2 qui donne H2O, si par exemple on cherche la masse de dioxygène nécessaire pour 12g d'eau. Parce que pour faire de l'eau on ne peux pas seulement utiliser du dioxygène.
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, je ne comprend pas ce problème !
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour,
J'ai une question : est ce que si on double les concentrations des espèces présentes dans un équilibre chimique, la constante K demeurera telle constante ou elle doublera elle aussi ?
Merci :)
-
Vérifiée par Alloprof
Secondaire 5 • 3aJe ne comprend pas la loi de Hess: comment calculer la variation d'enthalpie de réaction avec la démarche complète?
-
Vérifiée par Alloprof
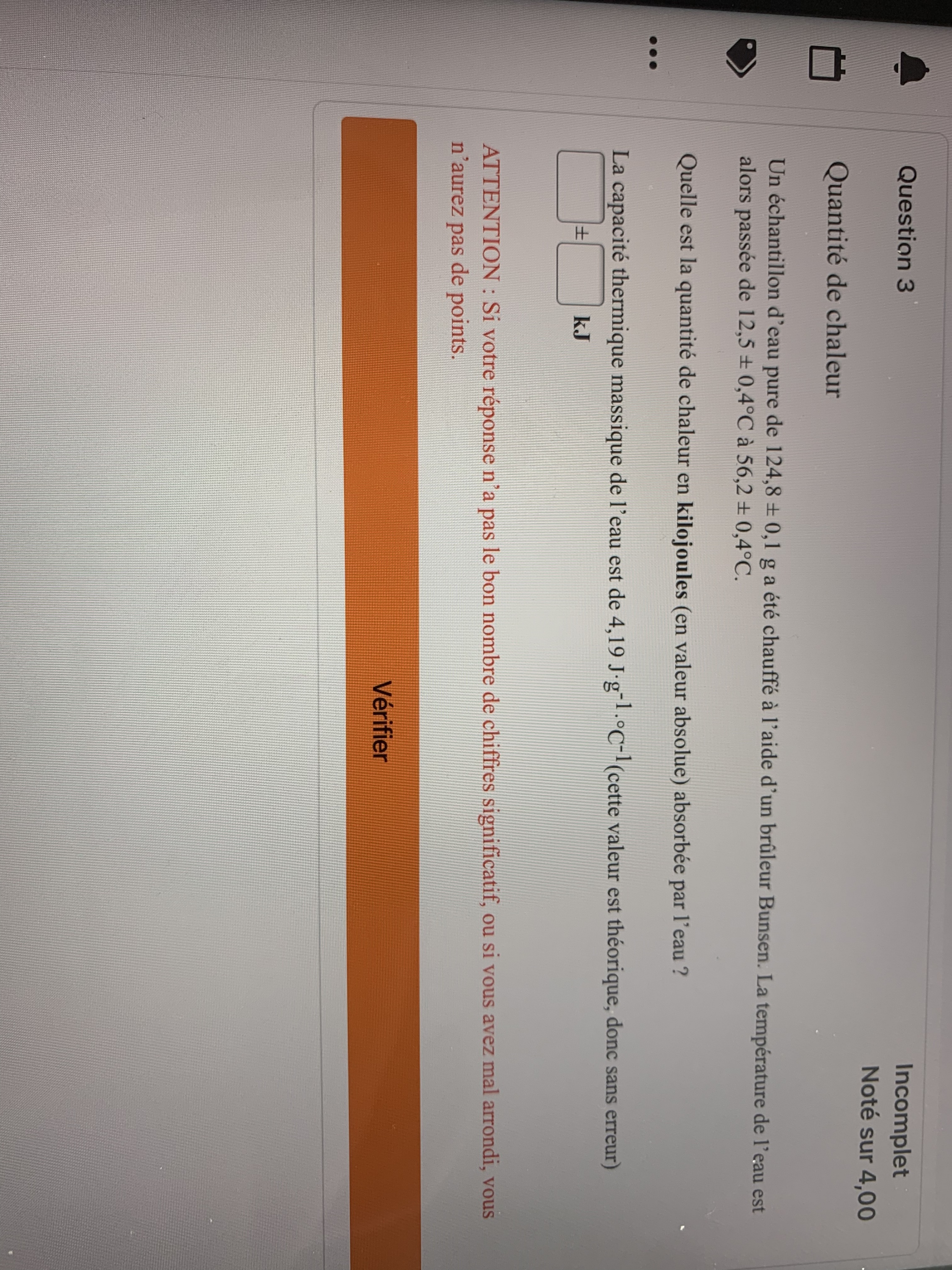
Secondaire 5 • 3aBonjour,
Je suis incapable de résoudre ce problème:Je souhaitais utiliser Q=m c delta T mais ça semble impossible Que faire?
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour,
J’ai récemment fait face à une question à laquelle j’avais de la difficulté à répondre, dans le cadre d’un laboratoire-devoir. Le laboratoire, bien que ne me rappel plus des chiffres exacts de certaines données, ressemblait à ceci :
Dans les sacs de « froid » (les sacs de plastiques refroidissants pour les blessures), il y a deux membranes de plastiques contenant des substances qui, une fois percées, entrent en action et effectuent une réaction qui a un effet refroidissant (donc une réaction endothermique, selon moi). Laquelle de ces deux substances aura le meilleur rapport quantité/efficacité? Soit :
1) lenitrate de potassium, qui a une solubilité de 1900 g/L
OU
2) lenitrate d’ammonium, qui a une solubilité de 357 g/L
Dans le laboratoire effectué, nous avons utilisé un calorimètre, et avons mesuré la température de 4,00 g de chacune des 2 substances à l’aide d’un thermomètre, lors de leur dissolution dans 750 ml d’eau distillée à température ambiante.
Les chiffres que nous avons obtenus sont respectivement :
- Température de l’eau (avant l’ajout du nitrate de potassium) : 28c
Température du système après la dissolution (du nitrate de potassium dans l’eau) : 21,5c
- Température de l’eau (avant la dissolution du nitrate d’ammonium) : 28c
Température du système après la dissolution (du nitrate de potassium dans l’eau) : 22c
Comment puis-je prouver un rapport à qui, je le pense bien, existe forcément, entre la solubilité des substances et l’enthalpie de leurs dissolutions, et ce, à l’aide des données trouvées dans le laboratoir-devoir?
Une aide serait grandement appréciée,
Merci!
-
Vérifiée par Alloprof
Primaire 6 • 3aBonjour,
C'est quoi la difference entre hydrogene et helium?
Merci.
-
Vérifiée par Alloprof
Postsecondaire • 3aBonsoir!
J’ai une petite idée de comment faire, mais je n’en suis pas sûr. J’aimerais savoir comment équilibrer cette équation.
Zn(OH)2 + H2O ——>
Merci :)
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour! Il y a un numéro en chimie que je ne comprends pas très bien…
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, ici, on me demande la vitesse générale de la réaction (N2(g) + 3H2(g) → 2 NH3(g))
mais on ne me spécifie pas le réactif/produit, comment la calculer ? et dans ce cas, est-ce que je dois diviser sa vitesse par le coefficient ou multiplier ?
merci
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonsoir.
je me demandais si la réponse de ce numéro, le 6, était vraie, car il me semble que la seule caractéristique qui varie la constante est la température et non la proportion, non?
le corrigé dit que la bonne réponse est le A).
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonsoir.
je me demandais si dans ce numéro, la réponse du réacteur 1 et 2 étaient fausses?
parce que pour le réacteur 1, comme la constante est plus petite que 20,3, c’est la réaction inverse qui est favorisée, non?
et pour le 2, comme la constante est plus grande que 20,3, la réaction directe?
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour
Dans la réaction aA + bB ➡️ cC + dD
on sait que les réactifs sont en solution. Alors comment écrire la vitesse de réaction des réactifs ?
merci !
-
Vérifiée par Alloprof
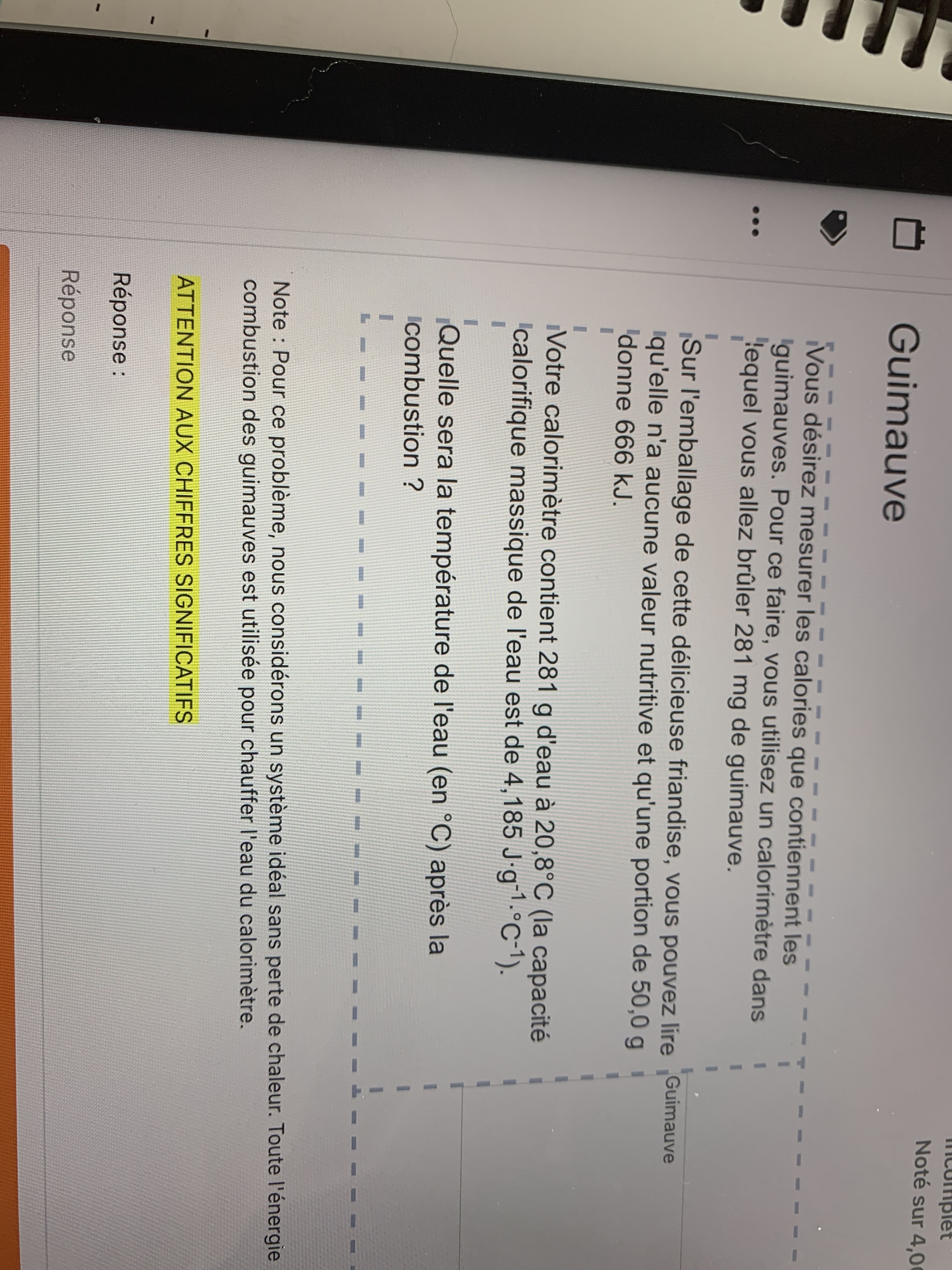
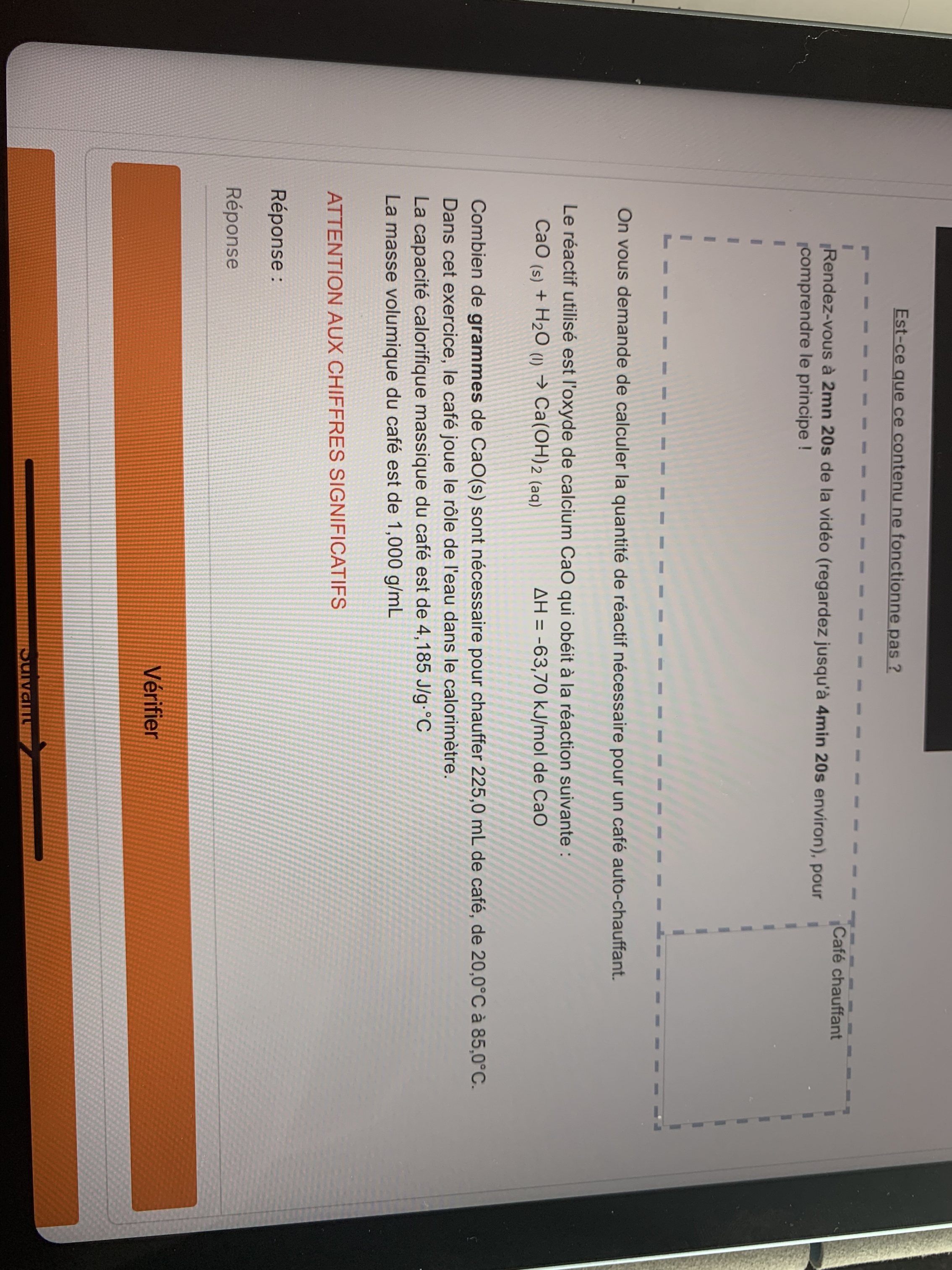
Secondaire 5 • 3aBonjour! J’ai de la difficulté avec ces trois problèmes. Serait-il possible de m’aider à les résoudre?
-
Vérifiée par Alloprof
Secondaire 5 • 3aJe ne comprend pas comment résoudre ce problème?
-
Vérifiée par Alloprof
Secondaire 5 • 3aComment calculez l'énergie dégagée lors de la formation des quantités de substances suivantes:
90g d'eau
231g de tétrachlorure de carbone
?
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonsoir,
Est-ce que dans ce numéro, l'épaisseur de la coquille diminuera, car à chaque étape, on arrive à une réaction de type inverse?
Dans le sens que les réactifs réagissent pour former des produits qui eux à leur tour deviennent des réactifs qui forment de nouveaux produits.Merci et bonne soirée! ;)
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonsoir,
Est-ce qu'ajouter du H2SO3(aq) augmentera la concentration de l'acide sulfureux dans ce cas?Merci et bonne soirée! ;)
-
Vérifiée par Alloprof
Primaire 5 • 3aRauno a mélangé une poudre rouge avec un acide incolore. Le lendemain la poudre rouge était au fond du bécher et l'acide était toujours incolore. Il s'agit d'un :Changement physiqueChangement chimiqueMerci en avance et bonne fête de Victoria!
JupiterAdmirable1839
-
Vérifiée par Alloprof
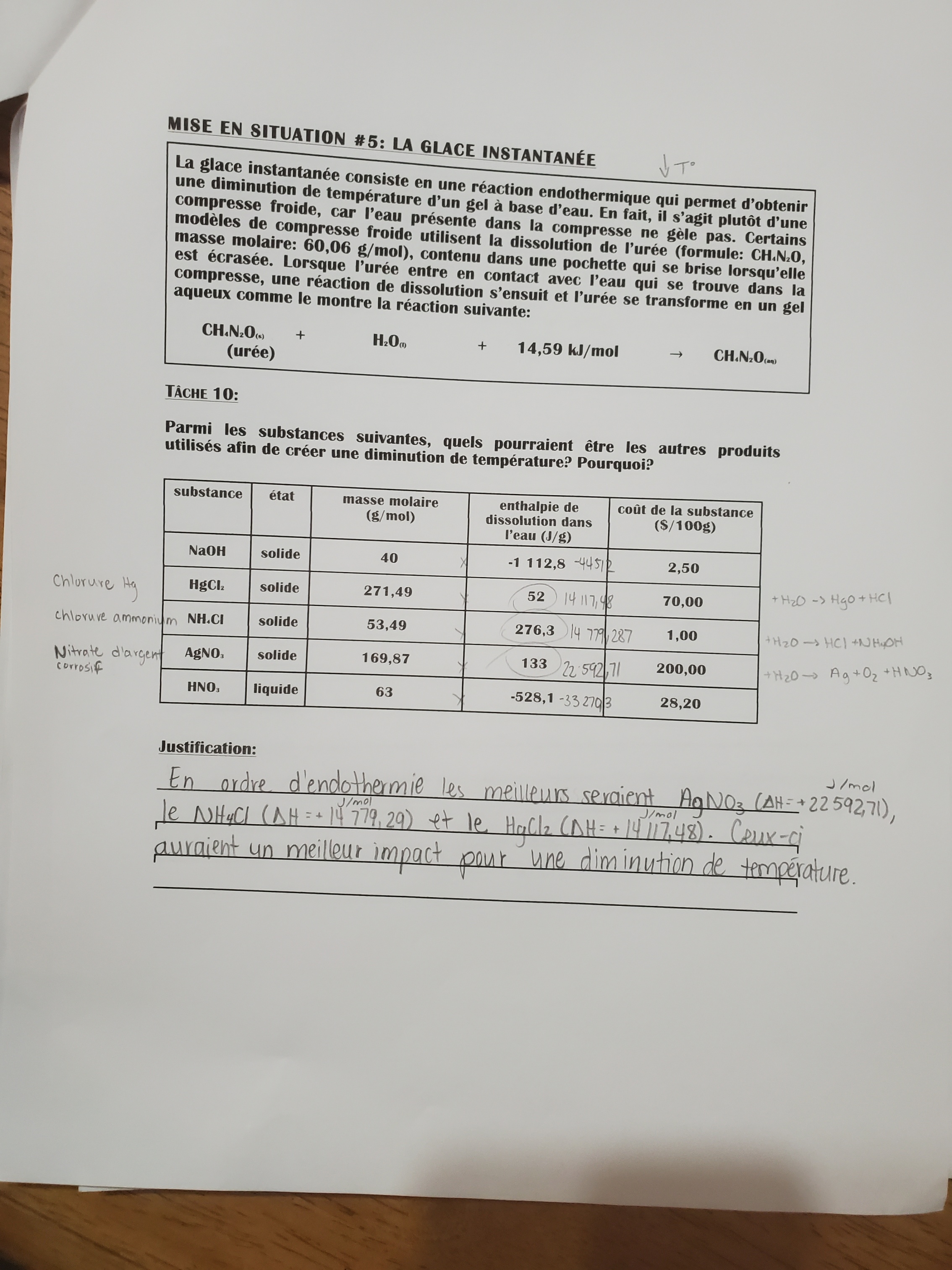
Secondaire 5 • 3aBonjour,
Par rapport à cette situation je ne comprend pas ce que je dois comparer à la tâche 11. Est-ce un calcul d'enthalpie? Je ne vois pas comment je peux comparer avec l'urée, car je n'ai pas de coût de substance ($/100g)
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, quelle est la bonne procédure pour la tâche 9? Je ne suis pas certain si le NaH2Ci est considéré comme une base ou un acide. De plus, j'ai de la difficulté à determiner les produits de la réaction
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour, est-ce que quelqu'un peut m'expliquer ce numéro? Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 3aBonjour! Je ne comprend pas vraiment le lien entre la constante d'acidité d'une solution acide et de sa concentration. J'ai une question dans mon laboratoire qui en parle mais je suis un peu perdue.