Liste de discussions
-
Vérifiée par Alloprof
Secondaire 4 • 2aBonjours, j’aimerais bien avoir un truc pour reconnaître les ions poly atomique
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour
chimie secondaire 5
J’ai une masse d’un gaz inconnu. 0,725 g
p: 103,1
v: 1 litre
r: 8,31
t: 296 k
masse molaire de l’air: 28,965
je cherche le gaz en question.
n: pv/rt
n: 0.04189
M: m/n
M: 17,31
mon 17,31 ne correspond pas.
Quelqu’un peut me diriger svp…
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour,
Voici le problème:
____________________________________
Mg(s) + 2HCl (aq) -> MgCl2(aq) + H2(g).
Le gaz produit par cette réaction est recueilli dans une bouteille et son volume est mesuré par déplacement d'eau. Lors du premier essai, la réaction de 0,050g de magnésium permet de recueillir 50,0 mL de gaz. Au deuxième essaie, 0,075g de magnésium est utilisé.
En supposant que la concentration d'acide chlorhydrique soit suffisante pour que le magnésium réagisse complètement, quel est le volume de gaz alors recueilli si l'expérience se déroule dans les mêmes conditions de température et de pression?
____________________________________
À mes yeux, le problème semble simple.
Je n'ai qu'à utiliser les coefficients stoechiométriques afin de faire un simple produit croisé. Donc, (50,0mL X 0,075g) / 0,050g = 75mL.
Toutefois, l'espace alloué pour mes démarches et au moins 3 fois supérieur pour ce numéro comparé au reste du cahier.
Ai-je raté quelque chose? Y a-t-il quelque chose que je ne prend pas en considération?
Merci beaucoup pour votre aide.
-
Vérifiée par Alloprof
Secondaire 5 • 2aj'arrive pas a comprendre cette exercices. je ne sais meme pas avec quoi je dois commencer. cest urgent svp T-T
-
Vérifiée par Alloprof
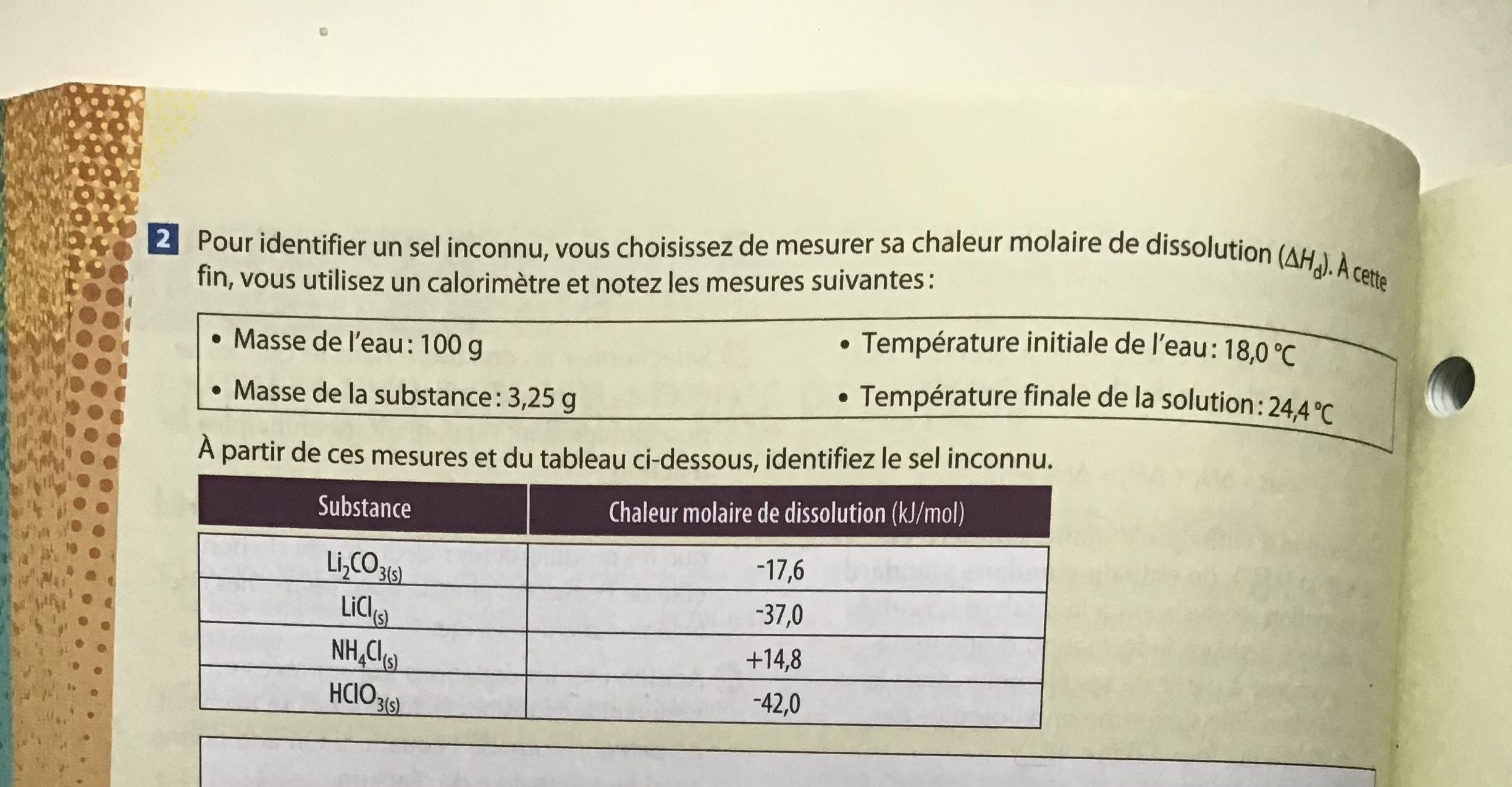
Secondaire 5 • 2aBonsoir, j’ai un rapport de laboratoire sur la chaleur molaire de dissolution. Je n’arrive pas à comprendre une des questions.
En gros, il fallait dissoudre au laboratoire deux sels (CH3COONa et KNO3) pour ensuite noter leur température initiale et finale et leur chaleur molaire. On a aussi la chaleur molaire de dissolution théorique (KJ/mol)
La question: Les variations de température auraient pu être plus élevées pour chacune des dissolutions ioniques des sels. Quelle modification suggérez-vous pour accroître l’écart de température sans augmenter la quantité de soluté utilisée?
Je sais qu’il faudrait diminuer la quantité de solvant utiliser mais je ne sais pas comment l’expliquer.
merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour! C'est encore moi! :D
En effet, j'avais mal exprimé ma question. Ce que je ne comprenais pas dans cette situation, c'est plutôt le fait que puisqu'habituellement en chimie, on ne met pas de signe d'environ devant une donnée imprécise/arrondie (car la valeur n'est presque jamais juste), pourquoi dans cette situation l'a-t-on mis?
Encore un gros merci! :D Bonne journée!
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonsoir,
Que dois-je faire dans cette réaction pour trouver le nombres de moles de NaOH?Merci et bonne soirée! ;)
-
Vérifiée par Alloprof
Secondaire 5 • 2aEn chimie, quand on a un graphique de variation d’énergie potentielle d’une réaction complexe, dans quelle situation va-t-on mettre le signe d’environ devant une valeur?
exemple de graphique:Voici la ce qui a suscité ma
curiosité:
la valeur de l’énergie
d’activation de la deuxième étape est d’environ 70 kJ/mol.
La variation de l’enthalpie de
la deuxième étape est d’environ 30 kJ/mol.
Merci beaucoup de votre temps et bonne journée !
ヾ(•ω•`)o
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonsoir, je ne comprends pas ce que ça veut dire.
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonsoir, je ne comprends pas pourquoi ici la réponse est 77.4kj/mol vu que la on a 6NOCl. Et non seulement un seul môle de NOCl.
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonsoir, c'est vraiment bizzare ce numéro comme si je fais 200g ×4.19×45 = ça ne donne aucune des réponses qui sont la.
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour, ce que dans ce numéro là je ne comprends pas vraiment pourquoi on a fait comme ça. Comme pourquoi on a pas multiplier 2 mol par le 2.02g/mol?
Merci
-
Vérifiée par Alloprof
Secondaire 5 • 2aje ne comprends pas ce problème.
-
Vérifiée par Alloprof
Secondaire 4 • 2aBonsoir,
Pourquoi est-il important de connaître le nombre d'électrons de valence pour les liaisons chimiques?
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonsoir,
Je ne comprends pas comment changer une donné de chaleur molaire en chaleur massique.
Quelles sont les opérations pour le faire?
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2aSi ma constante d'équilibre Kp est de 10000 à 500°c et que la pression de mes produits à l'équilibre est de 0,127 ATM comment je peux déterminer la pression totale du système à l'équilibre ??
-
Vérifiée par Alloprof
Secondaire 5 • 2aJe n'arrive pas à comprendre le coefficient steochiométrique comment équilibrer la formule
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour , j’ai pas compris comment je vais mesurer l’incertitude ici , pouvez vous m’expliquer svp pour les 2 exercices ?
merci
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour , j’ai pas compris comment répondre à ces 3 premières questions, pouvez vous m’aider svp?
merci
-
Vérifiée par Alloprof
Secondaire 5 • 2aJe ne comprend vraiment pas l'enthalpie et la chaleur molaire de dissolution en chimie. Mon examen est demain si jamais quelqu'un peut m'aider ce serait vraiment apprécié. Par exemple: Soit l'équation de dissolution du KOH: KOH-->K + OH
a) Quelle est la chaleur molaire de dissolution de l'hydroxyde de potassium si 5,6 grammes sont dissous dans 100 ml d'eau dont la température augmente de 10 degré celcius
b) Écrire l'équation thermochimique de cette équation
Merci de votre aide
-
Vérifiée par Alloprof
Secondaire 5 • 2aPour mon laboratoire, il faut verser 15 ml d'eau distillé dans un calorimètre. Ensuite, il faut ajouter 1g de CaCl2 dans le calorimètre contenant l'eau. il faut fermer le calorimètre le plus vite possible et agiter la solution jusqu'à temps que la température de la solution devient constante. Le but de l'expérience est de déterminer la chaleur molaire de dissolution du soluté dans l'eau.
Quelle modification suggérez-vous pour accroître l’écart de température sans augmenter la quantité de soluté utilisée?
Merci et bonne journée.
-
Vérifiée par Alloprof
Secondaire 5 • 2aJe n’ai pas d’idée… svp aidez moi.
-
Vérifiée par Alloprof
Postsecondaire • 2aJe dois calculer l’incertitude absolue sur une solution d’éthanol et d’eau qui a une concentration de 1 mol/L. La solution est de 50 mL et a été mesuré à l’aide d’une fiole donc l’incertitude est de 0,10 et elle contient un volume de 2,9 mL d’éthanol qui a été mesuré avec une concentration pipette gradué dont l’incertitude est de 0,05. Cependant je ne sais pas comment calculer l’incertitude, car la formule de la concentration est C=m/v, mais ici j’ai 2 volume.
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour,
Je me suis trompée à la lettre b de ce numéro. Pouvez-vous donc svp me l'expliquer?Merci et bonne journée! :)
-
Vérifiée par Alloprof
Secondaire 5 • 2aSalut,
Durant un laboratoire on a mélangé du vinaigre et du bicarbonate de soude dans une seringue et on a observé la quantité de gaz qui se dégageait de la réaction (en gros c'est l'augmentation de volume gazeux dans la seringue).
À l'aide de calculs stoechiométrique, on remarque que ni le vinaigre ni le bicarbonate ne sont des réactifs limitants. Du coup c'est impossible que la réaction ait atteint un équilibre stoechiométrique vu que tous les réactifs donnés dans l'équation ( CH3COOH + NaHCO3 -> CO2 + H2O + NaCH3COO) sont des réactifs en excés.
On essaye donc de comprendre comment ça se fait qu'il n'y ait pas eu de réactifs. Du coup, on s'est arrêtée à deux hypothèses. Serait-il possible que vous nous confirmez celle qui semble la plus logique ou de nous donner de nouvelles pistes s'il vous plaît?
HYPOTHÈSE 1:
Il y a un autre réactif en jeu qui n'est pas dans l'équation et on pense que c'est le gaz qui était déjà présent dans la seringue (Puisqu'on a placé une minuscule nacelle remplis de 0,2g de bicarbonate pour ensuite y ajouter environ 7mL de vinaigre du coup.) Du coup c'est ce mélange de gaz qui est limitant.
Bémole: Ça ne tient pas vraiment la route puisque ces gaz ne sont pas indispensables pour assurer la réaction.
HYPOTHÈSE 2:
Puisque la réaction s'est fait dans un système fermé, la seringue, on était limitée dans la quantité d'énergie disponible ce qui fait qu'il n'y en avait pas assez pour que tous les réactifs soient utilisés.
Bémole: Techniquement, c'est le réactif limitant qui détermine le moment auquel la réaction s'arrête. Alors on n'étaient pas certaines si ça changeait quelque chose dans ce raisonnement.
On espère y voir plus claire avec une nouvelle paire de yeux.
Merci!
-
Vérifiée par Alloprof
Secondaire 5 • 2aPour mon laboratoire, il faut verser 15 ml d'eau distillé dans un calorimètre. Ensuite, il faut ajouter 1g de CaCl2 dans le calorimètre contenant l'eau. il faut fermer le calorimètre le plus vite possible et agiter la solution jusqu'à temps que la température de la solution devient constante. Le but de l'expérience est de déterminer la chaleur molaire de dissolution du soluté dans l'eau.
il me faut 4 causes d'erreurs en lien avec la méthode et leurs améliorations. J'en ai trouvé 2 causes d'erreurs et 2 améliorations (imprécision des instruments et dégagement de gaz avant de boucher le calorimètre). Pouvez-vous m'aider à trouver les deux causes d'erreurs et leurs améliorations. Merci et bonne soirée!
-
Vérifiée par Alloprof
Secondaire 2 • 2acomment les sateillite fonctionnent
-
Vérifiée par Alloprof
Secondaire 5 • 2aPour mon laboratoire, il faut verser 15 ml d'eau distillé dans un calorimètre. Ensuite, il faut ajouter 1g de CaCl2 dans le calorimètre contenant l'eau. il faut fermer le calorimètre le plus vite possible et agiter la solution jusqu'à temps que la température de la solution devient constante. Le but de l'expérience est de déterminer la chaleur molaire de dissolution du soluté dans l'eau.
Je n'arrive pas à trouver deux causes d'erreurs en lien avec la méthode et leurs améliorations. Je sais que la première cause d'erreur est l'imprécision des instruments et qu'il faut des instruments plus précis. De plus, du gaz s'est échappé lorsqu'on a versé le soluté dans le calorimètre et j'ai trouvé l'amélioration. Pouvez-vous m'aider à trouver les deux causes d'erreurs et leurs améliorations. Merci et bonne journée!
-
Vérifiée par Alloprof
Secondaire 5 • 2aBonjour,
J'ai une question pour le bilan énergétique. Si on prend par exemple cette problème, on veut trouver le bilan énergétique on fait quoi avec le C ?
-
Vérifiée par Alloprof
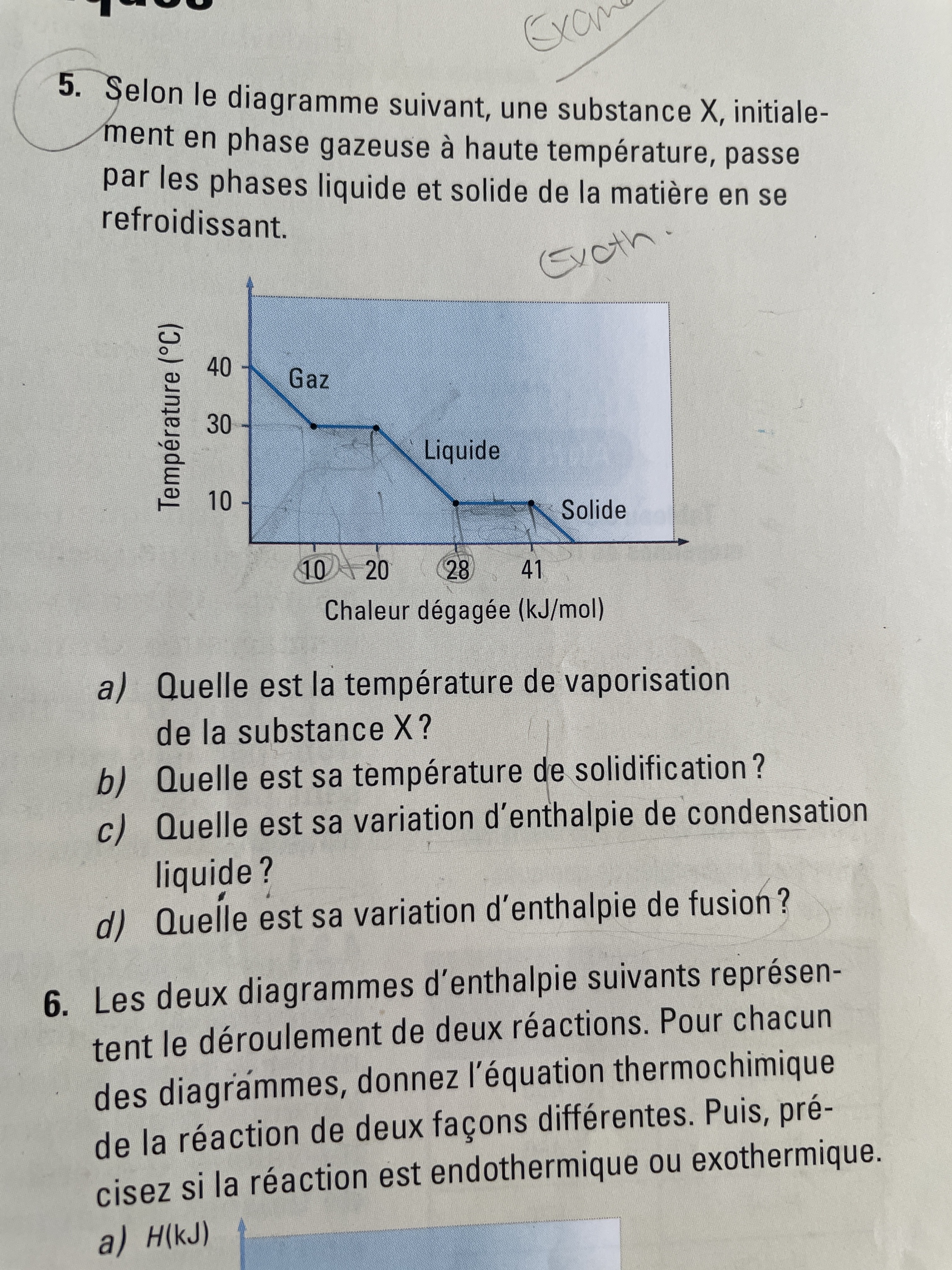
Secondaire 5 • 2aBonsoir, j'ai une question en chimie portant sur un laboratoire qui parle des réactions endothermiques et exothermiques. Le but de mon laboratoire était d'effectuer 8 expérience et de les classer selon leurs type de réactions. Tout simplement dire si la réaction est exothermique, physique ou chimique et finalement précisier si c'est une dissolution, neutralisation acidobasique, synthèse, de combustion, vaporisation.
L'expérience était la suivante : Attacher un morceau de gaze à un thermomètre à l'aide d'une élatique de caoutchouc et l'imbiber dans de l'éthanol.
Moi je me suis dit que c'est une reaction physique vu qu'il n'y à pas de changement de phase, que c'est une réaction endothermique car mes résulats me donne une variation de température (-) et donc c'est endothermique. Cependant je ne sais pas associer ma réaction à une dissolution, neutralisation acidobasique, synthèse, combustion, ou une vaporisation.
Merci enormément de votre aide et de votre temps. :)