Les périodes du tableau périodique
Les périodes
Une période est une ligne horizontale dans le tableau périodique des éléments.
Les sept périodes sont numérotées de haut en bas. Généralement, on trouve le numéro des périodes à gauche du tableau périodique. Dans l’image qui suit, les périodes sont identifiées à l’aide de couleurs différentes.

Attention!
Les lanthanides (éléments des numéros atomiques 58 à 71) font partie de la période 6.
Les actinides (éléments des numéros atomiques 90 à 103) font partie de la période 7.

Pour valider ta compréhension à propos du tableau périodique de façon interactive, consulte la MiniRécup suivante :

Le numéro d’une période et les couches électroniques
La classification des éléments en sept périodes distinctes permet de déterminer facilement le nombre de couches électroniques des éléments. Cela devient très utile lorsqu’il faut représenter des atomes à l’aide du modèle atomique de Rutherford-Bohr.
Astuce
Le nombre de couches électroniques d’un élément correspond au numéro de sa période dans le tableau périodique.
Comme on peut le voir dans l’image ci-dessous, les éléments qui ont un nombre différent de couches électroniques ne font pas partie de la même période. À l’inverse, les éléments qui ont un nombre identique de couches électroniques se retrouvent dans la même période.

L’aluminium (Al) se situe dans la troisième période du tableau périodique. L’aluminium a donc trois couches électroniques, tel que représenté à l’aide du modèle atomique de Rutherford-Bohr.

Recherche de l’aluminium dans le tableau périodique et son modèle de Rutherford-Bohr
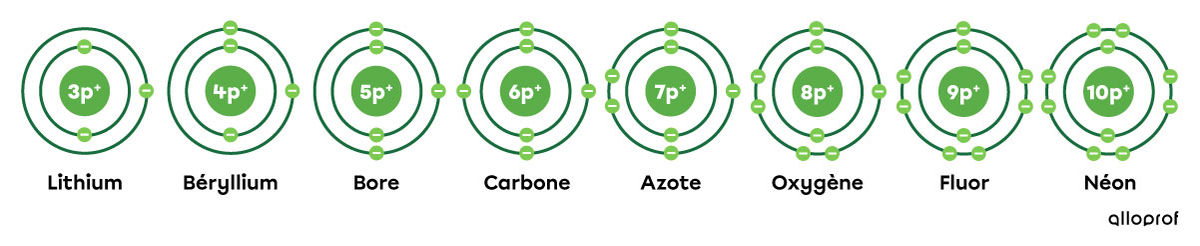
Le lithium (Li), le béryllium (Be), le bore (B), le carbone (C), l’azote (N), l’oxygène (O), le fluor (F) et le néon (Ne) font tous partie de la deuxième période du tableau périodique.

Lorsqu’on analyse leurs représentations selon le modèle de Rutherford-Bohr, on remarque que ces éléments ont tous deux couches électroniques.

L’hélium, le bore, le magnésium, le soufre et le calcium dans le tableau périodique
Voici la représentation d’éléments sélectionnés dans le tableau périodique ci-dessus selon le modèle atomique de Rutherford-Bohr.
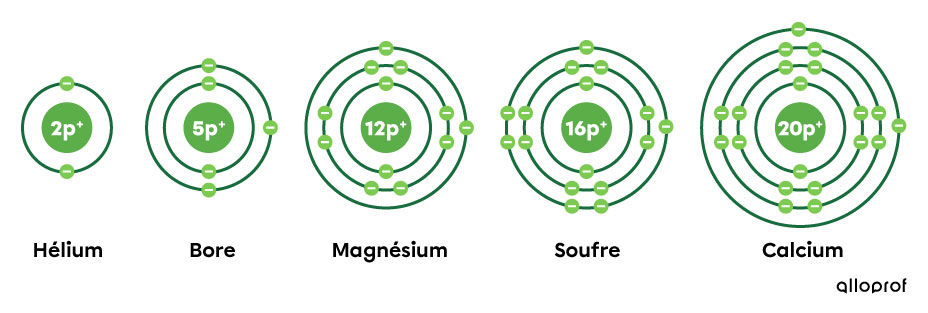
En observant la période où sont situés les éléments sélectionnés et leur représentation, on constate les faits suivants :
-
l’hélium fait partie de la première période, puisqu’il a une couche électronique;
-
le bore fait partie de la deuxième période, puisqu’il a deux couches électroniques;
-
le magnésium et le soufre font partie de la troisième période, puisqu’ils ont chacun trois couches électroniques;
-
le calcium fait partie de la quatrième période, puisqu’il a quatre couches électroniques.
Attention!
La première période contient seulement l’hydrogène (H) et l’hélium (He). Comme elle ne contient que deux éléments, cette période est facilement oubliée lorsque vient le temps de la repérer sur le tableau périodique.
Le nombre d’électrons sur une couche électronique
Les électrons d’un atome se situent sur ses couches électroniques. Plus un atome a d’électrons, plus il a de couches électroniques pour les contenir. La façon dont les électrons sont distribués dépend de la capacité maximale de chacune des orbites.
Astuce
Le nombre d’éléments dans une période du tableau périodique correspond au nombre maximum d’électrons que peut contenir cette couche électronique.

Attention!
Cette astuce est utilisée pour représenter la distribution des électrons sur les couches électroniques des éléments 1 à 20. À partir du numéro atomique 21, d’autres théories s’appliquent mieux pour représenter les atomes.
La distribution des électrons sur les couches électroniques se fait de manière à saturer les couches les plus près du noyau en premier.
Le calcium (Ca) a 20 électrons au total.
Sur le modèle de Rutherford-Bohr, on observe que les trois premières couches électroniques sont saturées d’électrons (2, 8 et 8 électrons), alors que la quatrième couche n’a que 2 électrons.
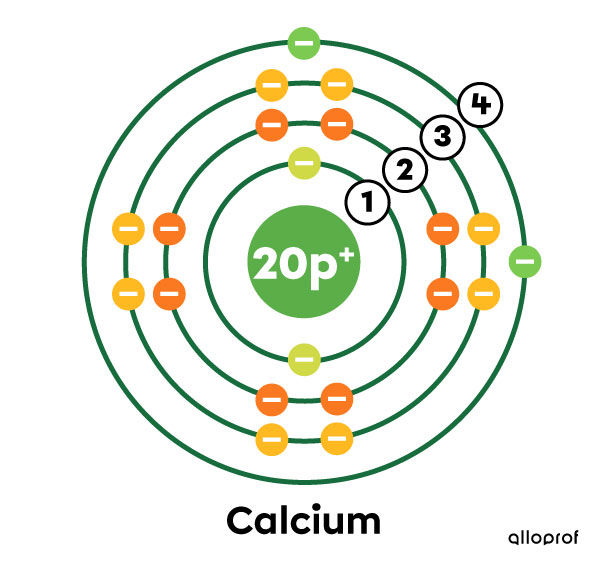
Un atome de calcium selon le modèle de Rutherford-Bohr
Pour valider ta compréhension à propos du tableau périodique de façon interactive, consulte la MiniRécup suivante :

Exercice
















































