
Les familles du tableau périodique
Secondaire 4
Une famille chimique regroupe les éléments qui ont des propriétés chimiques similaires. Les éléments d’une même famille sont placés dans la même colonne du tableau périodique des éléments.
Les familles du tableau périodique portent chacune un numéro de 1 à 18. Celles qui sont à l’étude au secondaire sont les familles 1, 2, 13, 14, 15, 16, 17, et 18. Leur numéro est un chiffre romain de I à VIII, suivi de la lettre A.
Ces familles sont en couleurs dans l’image suivante. Les familles en gris ne sont pas à l’étude au secondaire.
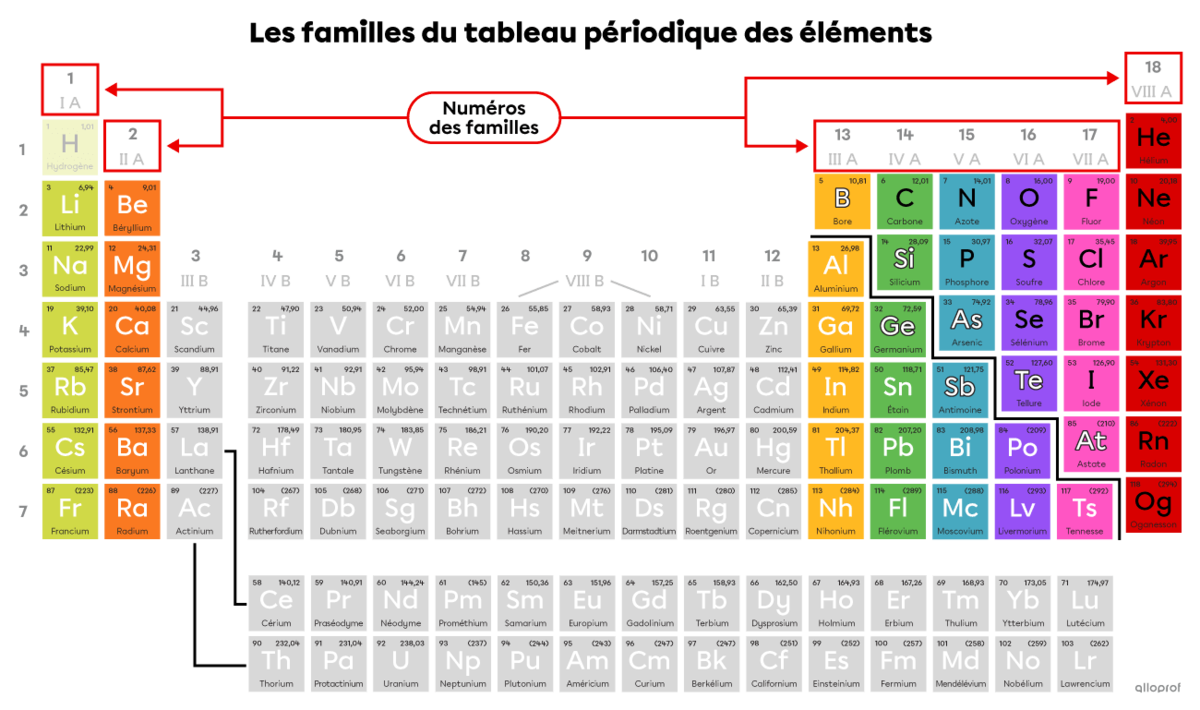
Remarque : Bien que l’hydrogène soit regroupé avec les éléments de la famille 1 (I A), il n’appartient à aucune famille chimique.
Le nombre d’électrons de valence selon la famille
Les électrons de valence sont les électrons qui sont situés sur la dernière couche électronique d’un atome.
Le nombre d’électrons de valence des atomes d’une famille est donné par le numéro en chiffres romains de cette famille. Le nombre d’électrons de valence correspond aussi au dernier chiffre du numéro de la famille en chiffres arabes.
|
Numéro de la famille en chiffres arabes |
1 |
2 |
13 |
14 |
15 |
16 |
17 |
18 |
|---|---|---|---|---|---|---|---|---|
|
Numéro de la famille en chiffres romains |
I A |
II A |
III A |
IV A |
V A |
VI A |
VII A |
VIII A |
|
Nombre d’électrons de valence |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
Attention!
L’hélium est dans la famille 18 (VIII A). Toutefois, il n’a que 2 électrons de valence, et non 8. Pourquoi a-t-il été classé dans la famille 18 et non dans la famille 2 (II A)? C’est parce que sa couche électronique est complète, comme celles des autres éléments de la famille 18. En effet, l’unique couche électronique de l’hélium peut contenir un maximum de 2 électrons. Cette caractéristique lui donne des propriétés chimiques similaires aux éléments de la famille 18.
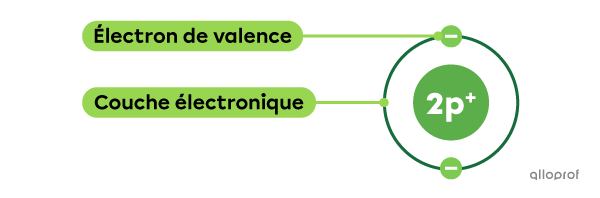
L’hélium
Représenté selon le modèle atomique de Rutherford-Bohr.
Les quatre familles importantes
Les deux premières et les deux dernières familles du tableau périodique sont intéressantes à cause de leurs propriétés chimiques particulières. Ces familles portent un nom spécifique, qui leur a été donné en fonction d’une propriété commune aux éléments qu’elle regroupe.

Important!
Bien qu’il soit dans la première colonne du tableau périodique et qu’il ait qu’un seul électron de valence, comme les alcalins, l’hydrogène ne fait pas partie de cette famille. Il est dans une famille à part, puisqu’il se comporte parfois comme un alcalin, parfois comme un halogène.
Les alcalins
-
Famille 1 ou I A.
-
Les alcalins ont 1 électron de valence.
-
Ils sont très réactifs, surtout avec les halogènes. Ils réagissent aussi avec l’eau pour former des bases. C’est pourquoi ils portent le nom d’alcalins. Alcalin est un synonyme de basique.
-
À cause de leur réactivité avec l'eau, et, par le fait même, avec l'humidité contenue dans l'air, on doit les entreposer dans l’huile.
-
Ce sont des métaux mous. Ils sont très malléables, très ductiles et très conducteurs d’électricité.
-
L’hydrogène ne fait pas partie de la famille des alcalins, même s’il est situé dans la même colonne du tableau périodique.

Du potassium
Source : loggy, Shutterstock.com
Les alcalinoterreux
-
Famille 2 ou II A.
-
Les alcalinoterreux ont 2 électrons de valence.
-
Ils sont réactifs, surtout avec les halogènes. Ils réagissent aussi avec l’eau pour former des bases. C’est pourquoi on retrouve le mot alcalin dans le nom alcalinoterreux. Alcalin est un synonyme de basique.
-
Ce sont des métaux moins mous que les alcalins. Ils sont malléables, ductiles et très conducteurs d’électricité.
-
On en trouve beaucoup dans la croute terrestre. C’est pourquoi il y a le mot terreux dans le nom alcalinoterreux.

Du magnésium
Source : RHJPhotos, Shutterstock.com
Les halogènes
-
Famille 17 ou VII A.
-
Les halogènes ont 7 électrons de valence.
-
Ils sont très réactifs. Ils réagissent avec les métaux pour former des sels. C’est d’ailleurs d’où vient leur nom. Halogène vient du grec hals gennân, qui signifie engendre un sel. Ces gaz réagissent avec l’hydrogène pour former des acides.
-
Les halogènes ont des propriétés désinfectantes. Par exemple, on utilise le chlore pour désinfecter l’eau.

Du chlore
Source : Rvkamalov gmail.com, Shutterstock.com
Les gaz inertes
-
Famille 18 ou VIII A.
-
La couche électronique la plus éloignée du noyau des gaz inertes est complète. L’hélium a 2 électrons de valence, tandis que le néon, l’argon, le krypton et le xénon ont 8 électrons de valence.
-
Les gaz inertes sont très peu réactifs. Ils n’ont pas tendance à réagir, à moins d’être soumis à des conditions particulières en laboratoire. C’est pourquoi on les appelle les gaz inertes. On les appelle aussi gaz nobles ou gaz rares.
-
Ils sont à l’état gazeux à conditions ambiantes.
-
Ils émettent de la lumière lorsqu’ils sont traversés par un courant électrique. C’est pourquoi il sont utilisés dans les enseignes lumineuses.

Un tube de néon
Source : Neon [photographie], Pslawinski, Wikimedia Commons, (https://commons.wikimedia.org/wiki/File:NeTube.jpg). Droits réservés*[1]
Exercice
Pour valider ta compréhension à propos du tableau périodique de façon interactive, consulte la MiniRécup suivante.

À voir aussi
Références















































