
Les réactions chimiques
Secondaire 3-4
Choisis ton niveau.
Secondaire 3
-
Une réaction chimique, parfois appelée changement chimique ou transformation chimique, se produit lorsqu’une ou plusieurs substances, les réactifs, interagissent pour former une ou plusieurs nouvelles substances, les produits.
-
Un réactif est une substance consommée au cours d’une réaction chimique. Sa quantité tend à diminuer.
-
Un produit est une substance formée au cours d’une réaction chimique. Sa quantité tend à augmenter.
Contrairement aux changements physiques, une réaction chimique modifie la nature des substances impliquées. En effet, les réactifs d’une réaction chimique n’ont pas les mêmes propriétés caractéristiques que les produits formés.
De plus, on peut reconnaitre la présence d’une réaction chimique grâce à certains indices, tels qu’un changement de couleur, un dégagement gazeux, la formation d’un précipité, etc.
Les réactions chimiques peuvent être représentées de différentes façons et regroupées en catégories qu’on appelle les types de réactions chimiques.
La représentation d’une réaction chimique
Différentes représentations sont utilisées pour décrire les substances impliquées dans une réaction chimique. On représente généralement une réaction chimique à l’aide du modèle particulaire ou à l’aide d’une équation chimique.
La représentation d’une réaction chimique à l’aide du modèle particulaire
Lorsqu’on représente une réaction chimique selon le modèle particulaire, les atomes sont généralement schématisés par des boules. La couleur et la grosseur des boules varient, de sorte que des atomes d’éléments différents sont représentés par des boules de couleur et/ou de taille différentes. De plus, les boules peuvent être assemblées pour représenter des molécules et des composés.
La réaction chimique de combustion du carbone peut être représentée à l'aide du modèle particulaire de la manière suivante. Dans cette réaction, 1 atome de carbone réagit avec 1 molécule de dioxygène pour produire 1 molécule de dioxyde de carbone.
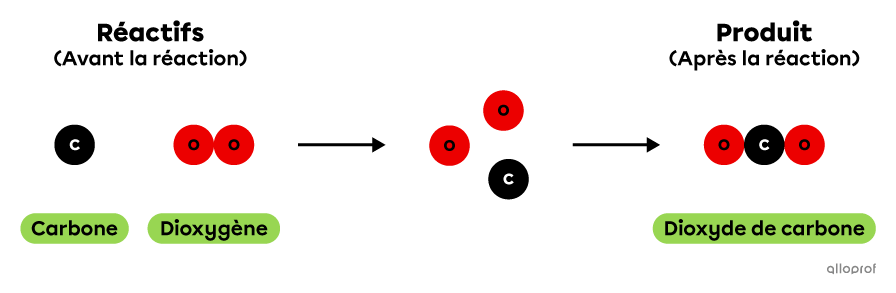
La combustion du carbone selon le modèle particulaire
Les types de réactions chimiques
Attention!
Une réaction chimique peut correspondre à plusieurs types de réactions à la fois. Par exemple, la réaction de respiration cellulaire correspond à la fois à une réaction d’oxydation et à une réaction de décomposition.
Les réactions de synthèse
Une réaction de synthèse est un type de réaction chimique où deux réactifs ou plus interagissent pour former un nouveau produit.
Astuce
On peut reconnaitre une réaction de synthèse en analysant le nombre de réactifs et de produits différents, ainsi que la complexité des substances impliquées.
Il est possible de reconnaitre une réaction de synthèse grâce aux indices suivants :
-
les réactifs sont plus nombreux que les produits;
-
les réactifs sont des substances plus simples que le ou les produits formés.
Dans la réaction suivante, de l’éthylène réagit avec du dihydrogène pour former de l’éthane.
Il s’agit d’une réaction de synthèse parce que deux réactifs, soit de l’éthylène et du dihydrogène, réagissent pour former un produit, de l’éthane. Les réactifs sont donc plus nombreux que les produits. De plus, les deux réactifs impliqués sont des molécules plus simples que le produit formé. En effet, l’éthylène et le dihydrogène contiennent chacun moins d’atomes que l’éthane.
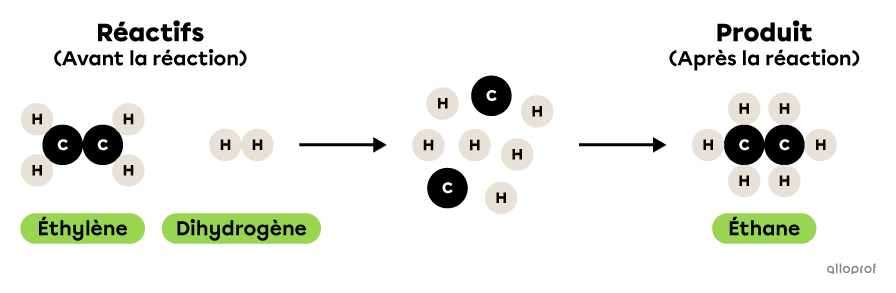
La synthèse de l’éthane
La photosynthèse est une réaction de synthèse dans laquelle du dioxyde de carbone réagit avec de l’eau en présence d’énergie lumineuse pour produire du glucose et du dioxygène.
On reconnait qu’il s’agit d’une réaction de synthèse parce que la molécule de glucose produite est plus complexe que les deux réactifs impliqués.
Chez les végétaux, cette réaction chimique se déroule dans les chloroplastes.
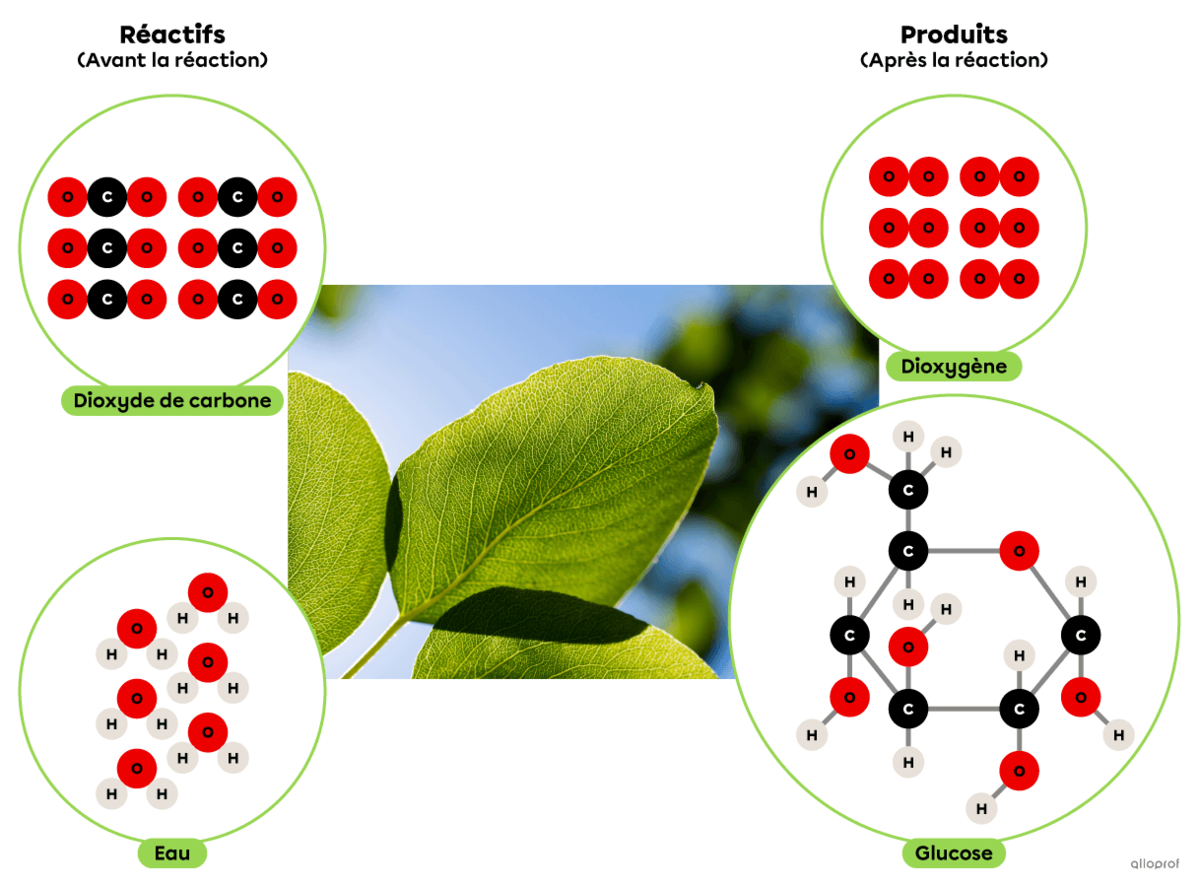
La photosynthèse selon le modèle particulaire
Adapté de martin.dlugo, shutterstock.com
Les réactions de décomposition
Une réaction de décomposition est un type de réaction chimique où les atomes d’un réactif se dissocient et se réorganisent pour former plusieurs produits.
Astuce
On peut reconnaitre une réaction de décomposition en analysant le nombre de réactifs et de produits différents, ainsi que la complexité des substances impliquées.
Il est possible de reconnaitre une réaction de décomposition grâce aux indices suivants :
-
les produits sont plus nombreux que les réactifs;
-
le ou les réactifs sont des substances plus complexes que les produits formés.
Lors de la réaction suivante, le peroxyde d’hydrogène se décompose pour former du dihydrogène et du dioxygène.
On reconnait qu’il s’agit d’une réaction de décomposition parce qu’un seul réactif, soit le peroxyde d’hydrogène, est décomposé pour former deux produits, soit du dihydrogène et du dioxygène. De plus, le peroxyde d’hydrogène est une molécule plus complexe que chacun des deux produits formés. En effet, elle contient plus d’atomes que le dihydrogène ou le dioxygène.
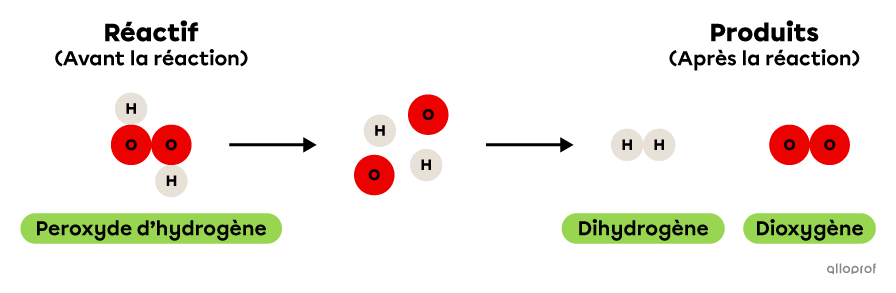
La décomposition du peroxyde d’hydrogène
Lors de la digestion chimique, des réactions de décomposition permettent à des molécules complexes, comme les constituants alimentaires, d’être décomposées en molécules plus simples et assimilables par l’organisme, les nutriments.
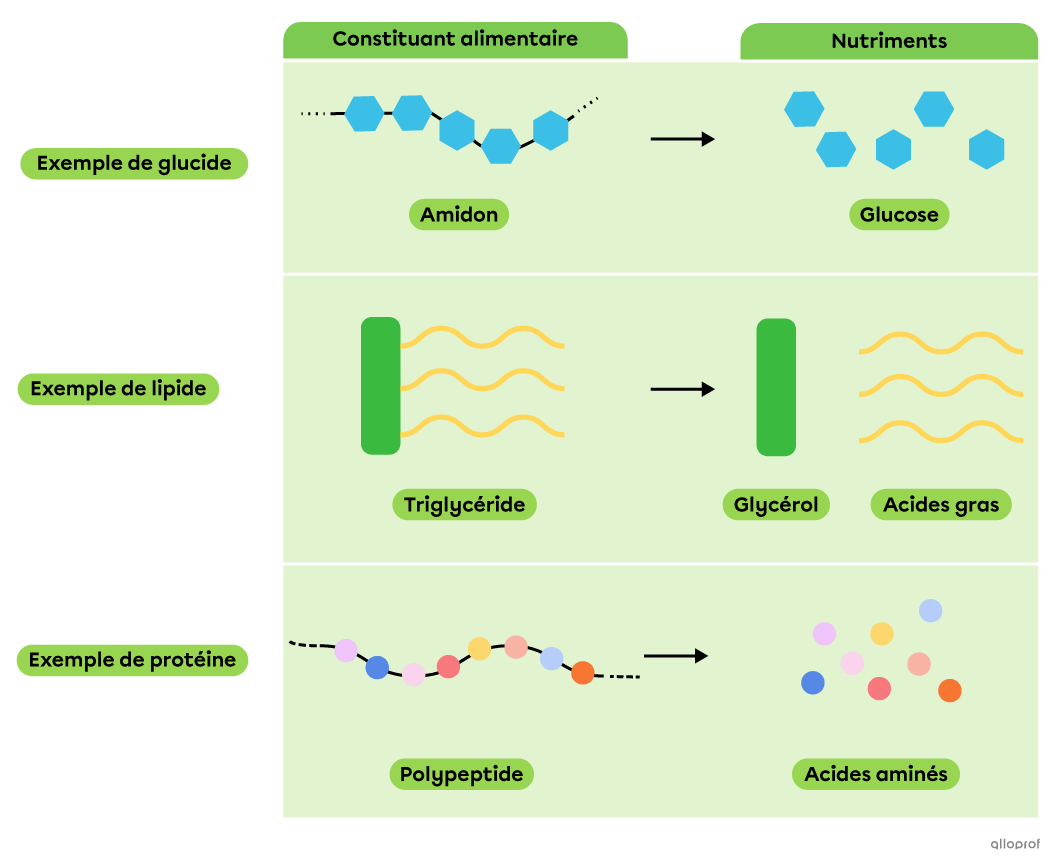
La décomposition des constituants alimentaires en nutriments
Les réactions de précipitation
Une réaction de précipitation est une réaction chimique qui se produit lorsque deux substances en solution interagissent de manière à produire un solide peu ou non soluble appelé précipité.
Lorsqu’on mélange une solution de chlorure de sodium avec une solution de nitrate d’argent, on observe la formation d’un précipité blanchâtre.
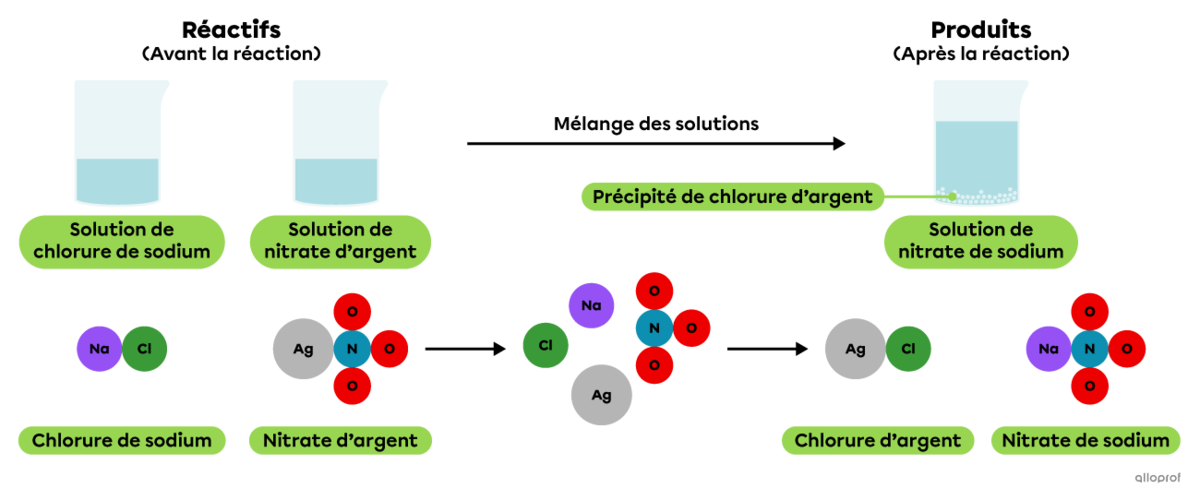
La précipitation du chlorure d’argent
Les réactions d’oxydation
Une réaction d’oxydation est une réaction chimique impliquant de l’oxygène ou une substance ayant des propriétés chimiques semblables à celles de l’oxygène dans les réactifs.
Lors de la réaction suivante, le fer réagit avec du dioxygène pour former de l’oxyde de fer, communément appelé de la rouille. Il s’agit en effet d’une réaction d’oxydation parce que le dioxygène est l’un des réactifs impliqués dans la réaction.

L’oxydation du fer
Adapté de Jin Odin et de OlegSam, shutterstock.com
Les réactions de combustion
Les réactions de combustion sont des réactions chimiques au cours desquelles il se produit une réaction d’oxydation et un dégagement d’énergie.
Lors de la réaction de combustion suivante, le propane réagit avec du dioxygène pour former du dioxyde de carbone et de l’eau. De plus, la combustion du propane produit un dégagement d’énergie thermique qui est couramment utilisé pour la cuisson des aliments ou pour le chauffage des immeubles.
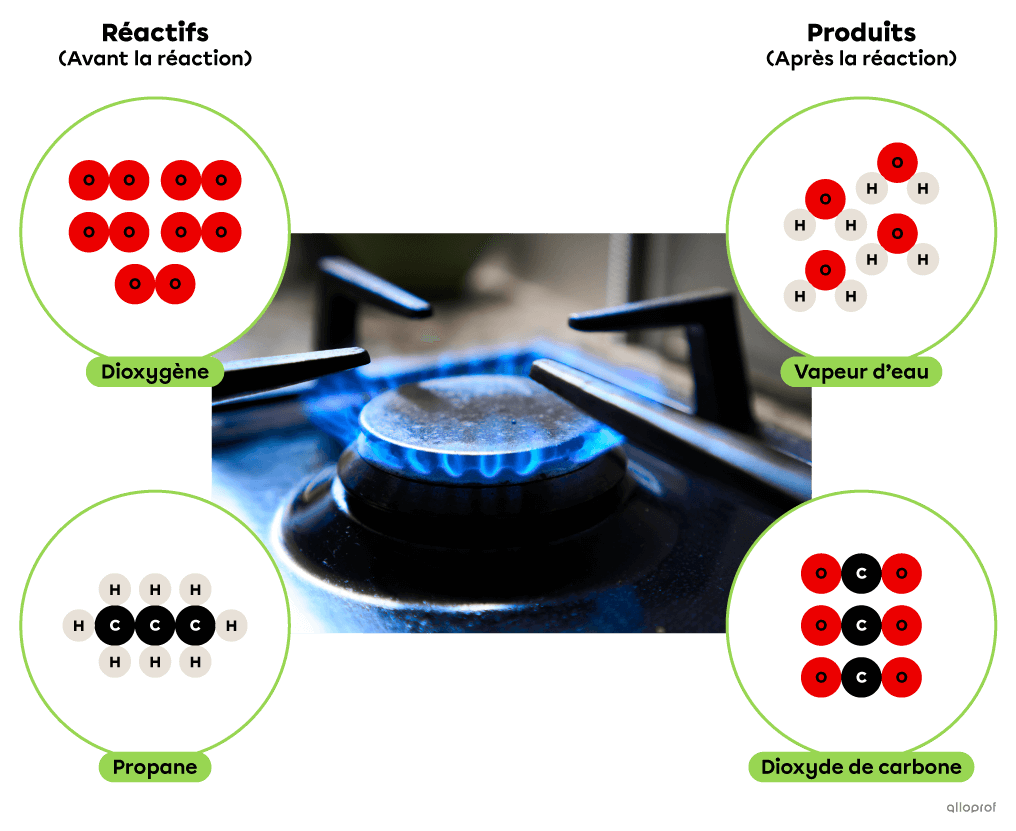
La combustion du propane
Adapté de Jin Odin, shutterstock.com
La respiration cellulaire est une réaction chimique se déroulant dans les cellules animales et végétales.
Elle comprend une réaction d’oxydation puisque le glucose réagit avec du dioxygène pour former du dioxyde de carbone et de la vapeur d’eau. De plus, la respiration cellulaire produit l’énergie essentielle au bon fonctionnement des cellules.
Puisqu’elle comprend une réaction d’oxydation et un dégagement d’énergie, on peut également affirmer que la respiration cellulaire est une réaction de combustion.
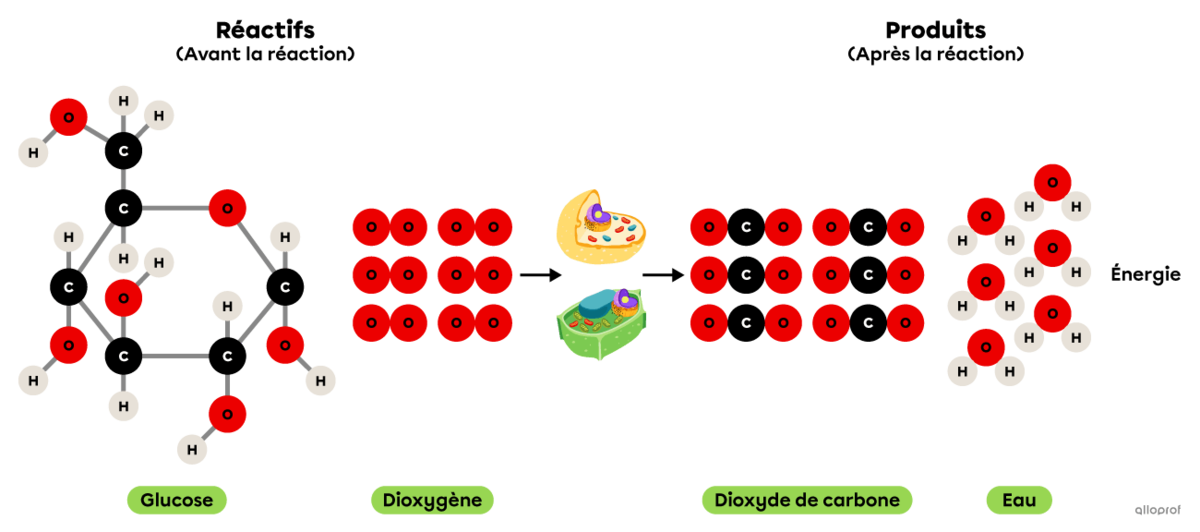
La respiration cellulaire
Secondaire 4
-
Une réaction chimique, parfois appelée changement chimique ou transformation chimique, se produit lorsqu’une ou plusieurs substances, les réactifs, interagissent pour former une ou plusieurs nouvelles substances, les produits.
-
Un réactif est une substance consommée au cours d’une réaction chimique. Sa quantité tend à diminuer.
-
Un produit est une substance formée au cours d’une réaction chimique. Sa quantité tend à augmenter.
Au cours d’une réaction chimique ou d’un changement chimique, des liaisons chimiques entre les atomes de réactifs sont brisées. Ainsi, les atomes se réorganisent de manière à former de nouvelles liaisons, ce qui permet la formation des produits.
Contrairement aux changements physiques, une réaction chimique modifie la nature des substances impliquées. En effet, les réactifs d’une réaction chimique n’ont pas les mêmes propriétés caractéristiques que les produits formés.
De plus, on peut reconnaitre la présence d’une réaction chimique grâce à certains indices, tels qu’un changement de couleur, un dégagement gazeux, la formation d’un précipité, etc.
Les réactions chimiques peuvent être représentées de différentes façons et regroupées en catégories qu’on appelle les types de réactions chimiques.
Les représentations d’une réaction chimique
Différentes représentations sont utilisées pour décrire les substances impliquées dans une réaction chimique. On représente généralement une réaction chimique à l’aide du modèle particulaire ou à l’aide d’une équation chimique.
La représentation d’une réaction chimique à l’aide du modèle particulaire
Lorsqu’on représente une réaction chimique selon le modèle particulaire, les atomes sont généralement schématisés par des boules. La couleur et la grosseur des boules varient, de sorte que des atomes d’éléments différents sont représentés par des boules de couleur et/ou de taille différentes. De plus, les boules peuvent être assemblées pour représenter des molécules et des composés.
La réaction chimique de combustion du carbone peut être représentée à l'aide du modèle particulaire de la manière suivante. Dans cette réaction, 1 atome de carbone réagit avec 1 molécule de dioxygène pour produire 1 molécule de dioxyde de carbone.
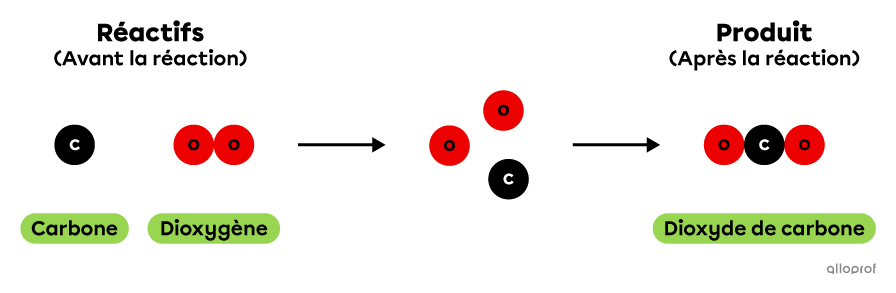
La combustion du carbone selon le modèle particulaire
La représentation d’une réaction chimique à l’aide d’une équation chimique
Une équation chimique est une représentation schématique des substances impliquées dans une réaction chimique sous la forme d’une équation.
Dans une équation chimique :
-
les réactifs et les produits sont représentés à l’aide de leurs formules chimiques;
-
les réactifs et les produits sont séparés par une flèche;
-
si une réaction chimique comprend plus d’un réactif ou plus d’un produit, leurs formules chimiques sont séparées par un signe d’addition |(+);|
-
des coefficients peuvent être placés devant les formules chimiques des réactifs et des produits pour représenter les proportions réelles selon lesquelles les substances interagissent.
Ainsi, une équation chimique prend généralement la forme suivante.
||\begin{align}\color{#FA7921}{\text{Réactifs}}&\rightarrow\color{#333FB1}{\text{Produits}}\\\color{#3A9A38}{a}\color{#FA7921}{\text{A}}\ +\ \color{#3A9A38}{b}\color{#FA7921}{\text{B}}&\rightarrow\color{#3A9A38}{c}\color{#333FB1}{\text{C}}\ +\ \color{#3A9A38}{d}\color{#333FB1}{\text{D}}\end{align}\\||
où
|\color{#FA7921}{\text{A, B}}:| formules chimiques des réactifs
|\color{#333FB1}{\text{C, D}}:| formules chimiques des produits
|\color{#3A9A38}{a,b,c,d}:| coefficients stœchiométriques
En savoir plus
Dans la majorité des situations rencontrées au secondaire, une flèche unidirectionnelle pointant vers les produits est utilisée pour séparer les réactifs des produits. On utilise cette flèche lorsque la réaction est irréversible, c'est-à-dire lorsque l’un des réactifs est entièrement consommé et transformé en produits.
||\text{Réactifs}\rightarrow\text{Produits}||
Il arrive que les produits formés réagissent à leur tour pour reformer les réactifs, ces réactions sont dites réversibles. On utilise alors une double flèche pour séparer les réactifs des produits.
||\text{Réactifs}\leftrightharpoons\text{Produits}||
L’équation squelette et l’équation chimique balancée
Une équation squelette est un type d’équation chimique utilisé pour représenter les substances impliquées dans une réaction, sans toutefois indiquer les proportions selon lesquelles les substances interagissent.
Dans une équation squelette, on retrouve les formules chimiques des substances impliquées, sans les coefficients stœchiométriques devant les formules chimiques. Autrement dit, une équation squelette est une équation chimique non balancée.
On peut représenter la réaction de combustion de l’amidon à l’aide de l’équation squelette suivante.
||\color{#FA7921}{\text{C}_6\text{H}_{10}\text{O}_5}\ +\ \color{#FA7921}{\text{O}_2}\rightarrow\color{#333FB1}{\text{CO}_2}\ +\ \color{#333FB1}{\text{H}_2\text{O}}||
Cette équation nous indique que lors de cette réaction, l’amidon |(\color{#FA7921}{\text{C}_6\text{H}_{10}\text{O}_5})| réagit avec le dioxygène |(\color{#FA7921}{\text{O}_2}),| pour former du dioxyde de carbone |(\color{#333FB1}{\text{CO}_2})| et de l’eau |(\color{#333FB1}{\text{H}_2\text{O}}).|
Une équation chimique balancée est un type d’équation chimique permettant d’indiquer les proportions réelles selon lesquelles des substances interagissent dans une réaction chimique.
Pour représenter les proportions réelles selon lesquelles les substances interagissent dans une réaction chimique, l’équation doit refléter la loi de la conservation de la matière et présenter un nombre égal d’atomes de chaque élément des deux côtés de l’équation, soit du côté des réactifs et du côté des produits.
Pour y arriver, on doit balancer l’équation chimique en ajoutant, au besoin, des coefficients stœchiométriques devant les formules chimiques des substances impliquées.
On peut représenter la réaction de combustion de l’amidon à l’aide de l’équation chimique balancée suivante.
||\color{#FA7921}{\text{C}_6\text{H}_{10}\text{O}_5}\ +\ \color{#3A9A38}{6}\ \color{#FA7921}{\text{O}_2}\rightarrow\color{#3A9A38}{6}\ \color{#333FB1}{\text{CO}_2}\ +\ \color{#3A9A38}{5}\ \color{#333FB1}{\text{H}_2\text{O}}||
Remarque : Lorsque le coefficient stœchiométrique d’une substance est de 1, il n’est pas représenté dans l’équation.
L’équation précédente nous indique que |\color{#3A9A38}{1}| molécule d’amidon |(\color{#FA7921}{\text{C}_6\text{H}_{10}\text{O}_5})| réagit avec |\color{#3A9A38}{6}| molécules de dioxygène |(\color{#FA7921}{\text{O}_2})| pour produire |\color{#3A9A38}{6}| molécules de dioxyde de carbone |(\color{#333FB1}{\text{CO}_2})| et |\color{#3A9A38}{5}| molécules d’eau |(\color{#333FB1}{\text{H}_2\text{O}}).|
Les types de réactions chimiques
Attention!
Une réaction chimique peut correspondre à plusieurs types de réactions à la fois. Par exemple, la réaction de respiration cellulaire correspond à la fois à une réaction d’oxydation et à une réaction de décomposition.
Les réactions de synthèse
Une réaction de synthèse est un type de réaction chimique où deux réactifs ou plus interagissent pour former un nouveau produit.
Astuce
On peut reconnaitre une réaction de synthèse en analysant le nombre de réactifs et de produits différents, ainsi que la complexité des substances impliquées.
Il est possible de reconnaitre une réaction de synthèse grâce aux indices suivants :
-
les réactifs sont plus nombreux que les produits;
-
les réactifs sont des substances plus simples que le ou les produits formés.
Lors de la réaction chimique suivante, de l’éthylène |(\text{C}_2\text{H}_4)| réagit avec du dihydrogène |(\text{H}_2)| pour former de l’éthane |(\text{C}_2\text{H}_6).|
On reconnait qu’il s’agit d’une réaction de synthèse parce que deux substances, soit de l’éthylène |(\text{C}_2\text{H}_4)| et du dihydrogène |(\text{H}_2),| réagissent pour former un seul produit, soit de l’éthane |(\text{C}_2\text{H}_6).| De plus, les deux réactifs impliqués sont des molécules plus simples que le produit formé. En effet, l’éthylène |(\text{C}_2\text{H}_4)| et le dihydrogène |(\text{H}_2)| contiennent chacun moins d’atomes que l’éthane |(\text{C}_2\text{H}_6).|

La synthèse de l’éthane
La photosynthèse est une réaction de synthèse dans laquelle du dioxyde de carbone |(\text{CO}_2)| réagit en présence d’énergie lumineuse et d’eau |(\text{H}_2\text{O})| pour produire du glucose |(\text{C}_6\text{H}_{12}\text{O}_6)| et du dioxygène |(\text{O}_2).|
On reconnait qu’il s’agit d’une réaction de synthèse parce que la molécule de glucose |(\text{C}_6\text{H}_{12}\text{O}_6)| produite est plus complexe que les deux réactifs impliqués (|\text{CO}_2| et |\text{H}_2\text{O}|).
Chez les végétaux, cette réaction chimique se déroule dans les chloroplastes.

martin.dlugo, shutterstock.com
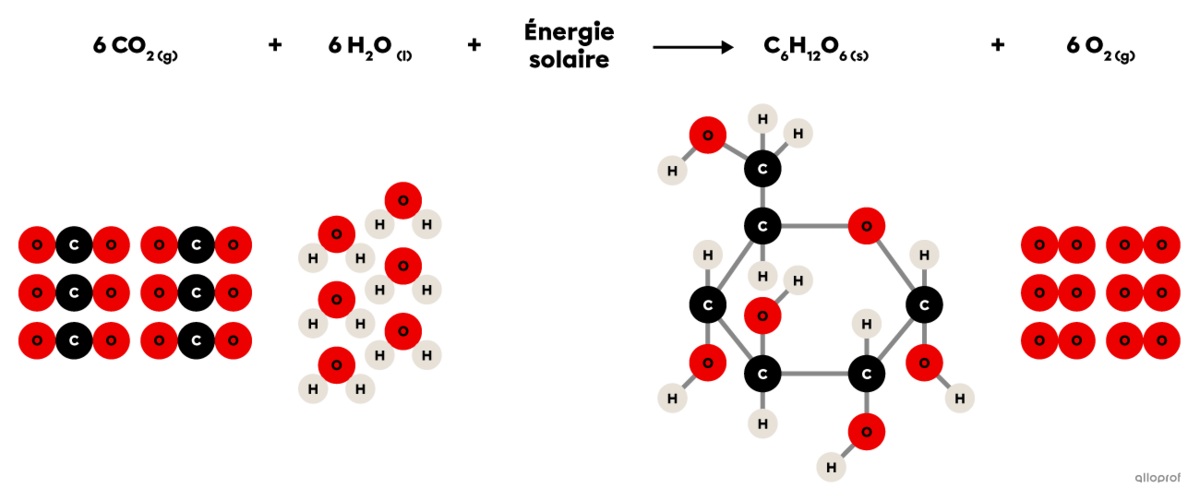
L’équation chimique balancée de la photosynthèse
Les réactions de décomposition
Une réaction de décomposition est un type de réaction chimique où les atomes d’un réactif se dissocient et se réorganisent pour former plusieurs produits.
Astuce
On peut reconnaitre une réaction de décomposition en analysant le nombre de réactifs et de produits différents, ainsi que la complexité des substances impliquées.
Il est possible de reconnaitre une réaction de décomposition grâce aux indices suivants :
-
les produits sont plus nombreux que les réactifs;
-
le ou les réactifs sont des substances plus complexes que les produits formés.
Lors de la réaction suivante, le peroxyde d’hydrogène |(\text{H}_2\text{O}_2)| se décompose pour former du dihydrogène |(\text{H}_2)| et du dioxygène |(\text{O}_2).|
On reconnait qu’il s’agit d’une réaction de décomposition parce qu’un seul réactif, soit le peroxyde d’hydrogène |(\text{H}_2\text{O}_2),| est décomposé pour former deux produits, soit du dihydrogène |(\text{H}_2)| et du dioxygène |(\text{O}_2).|
De plus, le peroxyde d’hydrogène |(\text{H}_2\text{O}_2)| est une molécule plus complexe que chacun des deux produits formés. En effet, elle contient plus d’atomes que le dihydrogène |(\text{H}_2)| ou le dioxygène |(\text{O}_2).|

La décomposition du peroxyde d’hydrogène
Lors de la digestion chimique, des réactions de décomposition permettent à des molécules complexes, comme les constituants alimentaires, d’être décomposées en molécules plus simples et assimilables par l’organisme, les nutriments.
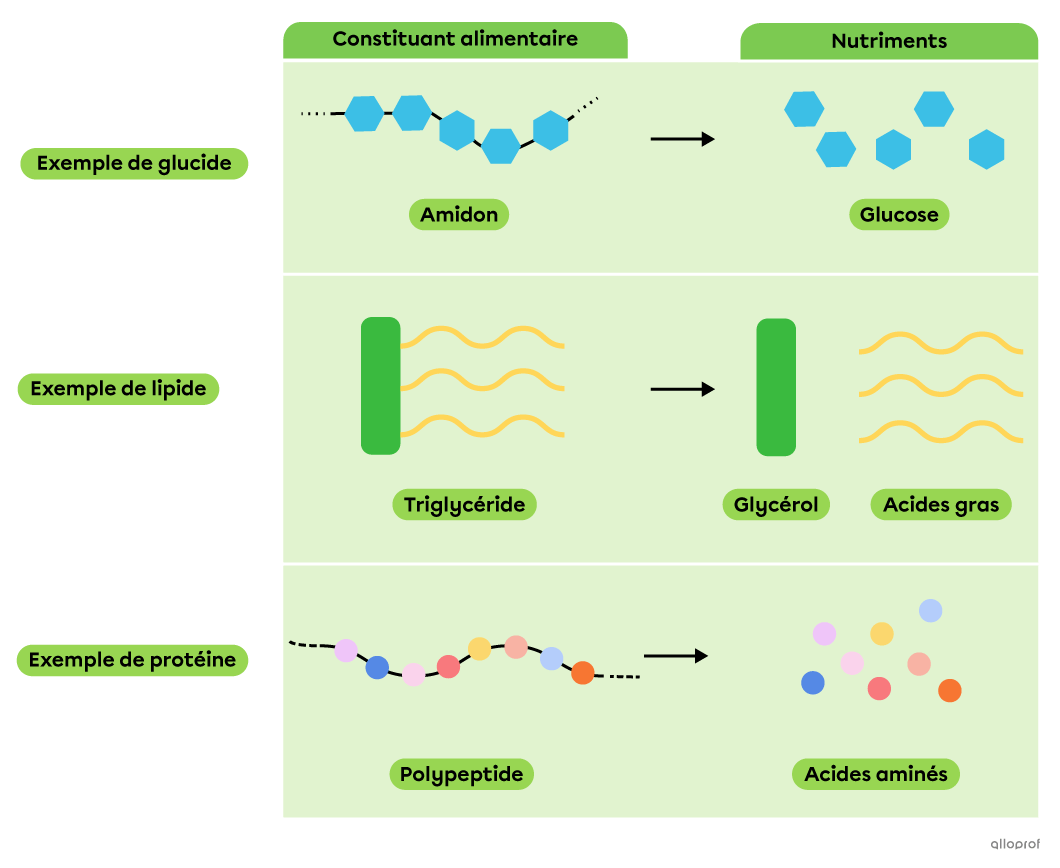
La décomposition des constituants alimentaires en nutriments
Les réactions de précipitation
Une réaction de précipitation est une réaction chimique qui se produit lorsque deux substances en solution interagissent de manière à produire un solide peu ou non soluble appelé précipité.
Astuce
On peut reconnaitre l’équation chimique d’une réaction de précipitation en analysant l’état physique des substances impliquées dans la réaction.
Il est possible de reconnaitre une réaction de précipitation grâce aux indices suivants :
-
Un des produits est à l’état solide;
-
Les autres substances impliquées sont en solution aqueuse.
En solution, le chlorure de sodium |(\text{NaCl})| se dissocie en ions |\text{Na}^+| et |\text{Cl}^-,| tandis que le nitrate d’argent |(\text{AgNO}_3)| se dissocie en ions |\text{Ag}^+| et |\text{NO}_3^-.|
Lorsqu’on mélange une solution de chlorure de sodium |(\text{NaCl})| avec une solution de nitrate d’argent |(\text{AgNO}_3),| les ions |\text{Ag}^+| et |\text{Cl}^-| s’associent pour former du chlorure d’argent |(\text{AgCl}).| Il s’agit d’un composé ionique peu ou non soluble qui se dépose pour former un précipité blanchâtre.
On reconnait qu’il s’agit d’une réaction de précipitation parce que l’équation chimique indique qu’un produit, le chlorure d’argent |(\text{AgCl}),| est à l’état solide et que les autres substances impliquées sont en solution aqueuse.
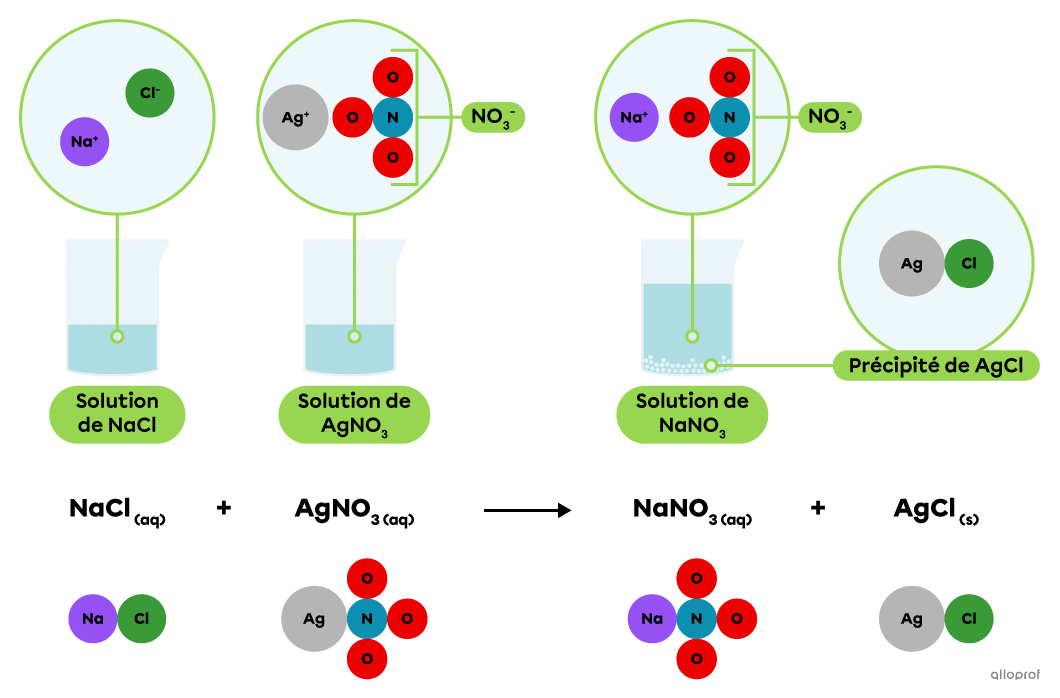
La précipitation du chlorure d’argent
Les réactions d’oxydation
Une réaction d’oxydation est une réaction chimique au cours de laquelle un élément subit une perte d’électrons. Cette perte d'électrons est due à la présence d’oxygène, ou d’une autre substance ayant des propriétés chimiques semblables, dans les réactifs.
Astuce
On peut reconnaitre une réaction d’oxydation à la présence d’un agent oxydant dans les réactifs. Le dioxygène |(\text{O}_2),| l’ozone |(\text{O}_3)| et le chlore |(\text{Cl})| sont des oxydants fréquemment rencontrés dans les réactions d’oxydation.
Lors de la réaction suivante, le fer |(\text{Fe})| réagit avec du dioxygène |(\text{O}_2)| pour former de l’oxyde de fer |(\text{Fe}_2\text{O}_3),| communément appelé de la rouille.
On reconnait qu’il s’agit d’une réaction d’oxydation parce qu'un oxydant, le dioxygène |(\text{O}_2),| est présent du côté des réactifs.

Clou oxydé
OlegSam, shutterstock.com
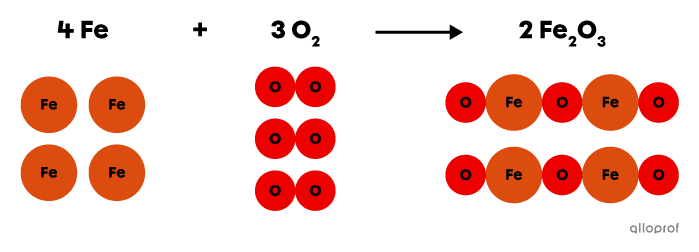
L’oxydation du fer
En savoir plus
Une réaction d’oxydation est une réaction chimique où un élément subit une perte d’électrons. Forcément, si un élément tend à donner des électrons au cours d’une réaction, un autre élément tend à les recevoir. Lorsqu’un élément reçoit des électrons, il s’agit plutôt d’une réaction de réduction.
Puisque chaque réaction d’oxydation est accompagnée d’une réaction de réduction, on nomme réaction d’oxydoréduction la combinaison de ces deux réactions chimiques inséparables.
Les réactions de combustion
Les réactions de combustion sont des réactions chimiques au cours desquelles il se produit une réaction d’oxydation et un dégagement d’énergie.
Lors de la réaction de combustion suivante, le propane |(\text{C}_3\text{H}_8)| réagit avec du dioxygène |(\text{O}_2)| pour former du dioxyde de carbone |(\text{CO}_2)| et de l’eau |(\text{H}_2\text{O}).| De plus, la combustion du propane produit un dégagement d’énergie thermique qui est couramment utilisé pour la cuisson des aliments ou pour le chauffage des immeubles.

Combustion de propane
Jin Odin, shutterstock.com
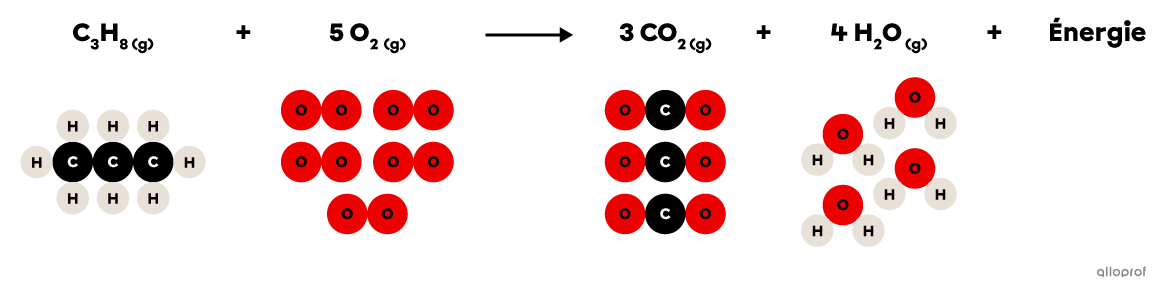
La combustion du propane
La respiration cellulaire est une réaction chimique se déroulant dans les cellules animales et végétales.
Elle comprend une réaction d’oxydation puisque le glucose |(\text{C}_6\text{H}_12\text{O}_6)| réagit avec du dioxygène |(\text{O}_2)| pour former du dioxyde de carbone |(\text{CO}_2)| et de la vapeur d’eau |(\text{H}_2\text{O}).| De plus, la respiration cellulaire produit l’énergie essentielle au bon fonctionnement des cellules.
Puisqu’elle comprend une réaction d’oxydation et un dégagement d’énergie, on peut également affirmer que la respiration cellulaire est une réaction de combustion.
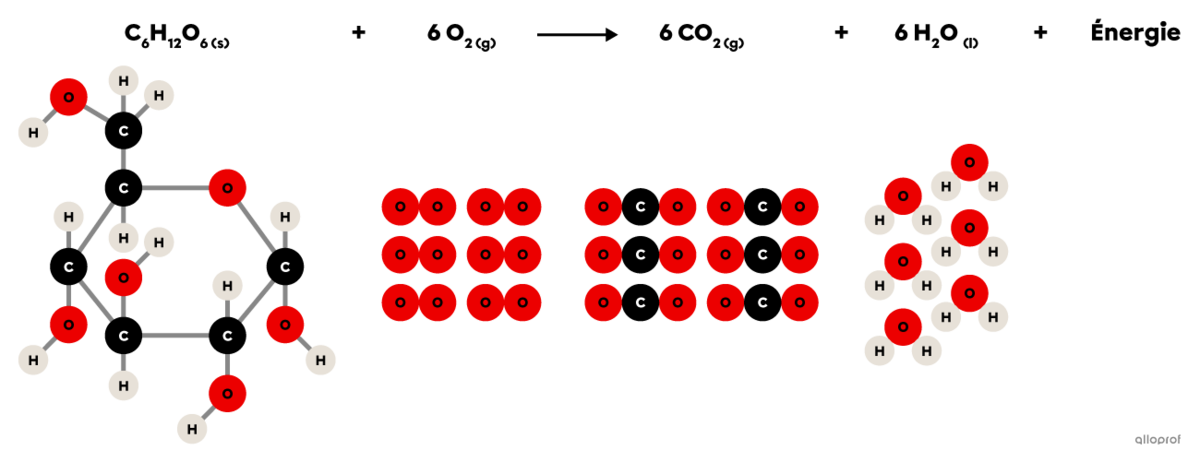
La respiration cellulaire
Les réactions de neutralisation acidobasique
Une réaction de neutralisation acidobasique est une réaction chimique au cours de laquelle un acide réagit avec une base pour produire un sel et de l’eau.
||\text{Acide}_{\text{(aq)}}\ +\ \text{Base}_{\text{(aq)}}\rightarrow\text{Sel}_{\text{(aq)}}\ +\ \text{Eau}_{\text{(l)}}||
Une solution d’hydroxyde de sodium |(\text{NaOH})| peut être neutralisée par une solution d’acide chlorhydrique |(\text{HCl}).| Une fois en solution, ces deux substances libèrent des ions qui se combinent pour former un sel, soit le chlorure de sodium |(\text{NaCl}),| et de l’eau |(\text{H}_2\text{O}).|
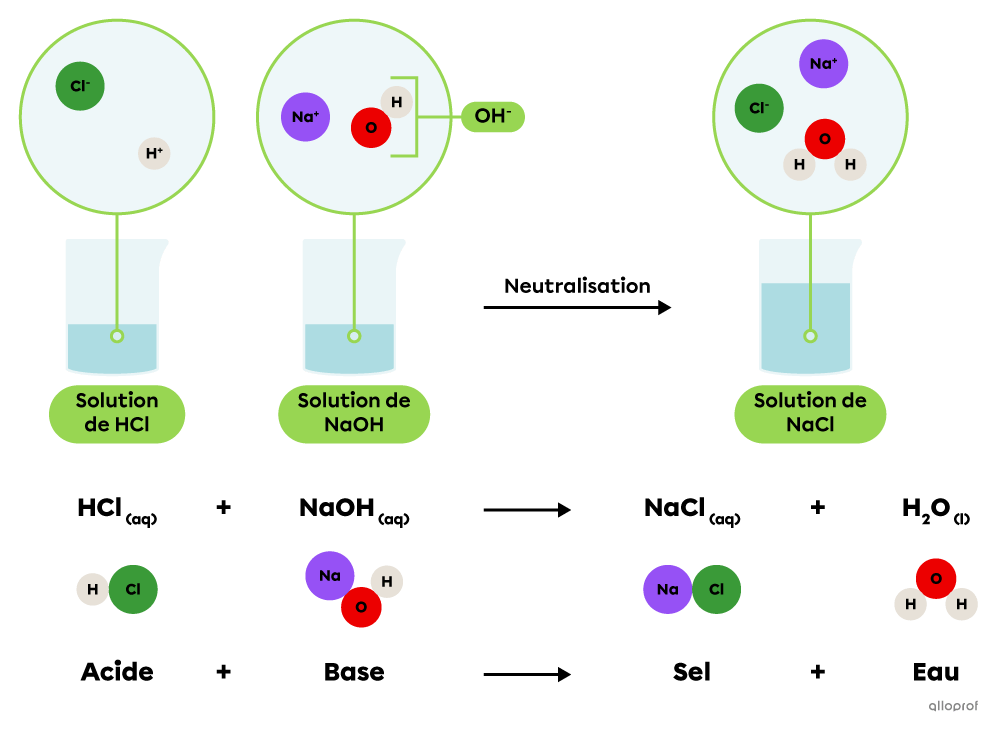
La neutralisation acidobasique
Dans cette page
- Haut de page
- Secondaire 3
- La représentation d’une réaction chimique
- La représentation d’une réaction chimique à l’aide du modèle particulaire
- Les types de réactions chimiques
- Les réactions de synthèse
- Les réactions de décomposition
- Les réactions de précipitation
- Les réactions d’oxydation
- Secondaire 4
- Les représentations d’une réaction chimique
- La représentation d’une réaction chimique à l’aide du modèle particulaire
- La représentation d’une réaction chimique à l’aide d’une équation chimique
- Définition
- Les types de réactions chimiques
- Les réactions de synthèse
- Exemple
- Les réactions de décomposition
- Les réactions de précipitation
- Les réactions d’oxydation
- Les réactions de neutralisation acidobasique















































