Secondaire 5 • 1a
Bonjour,
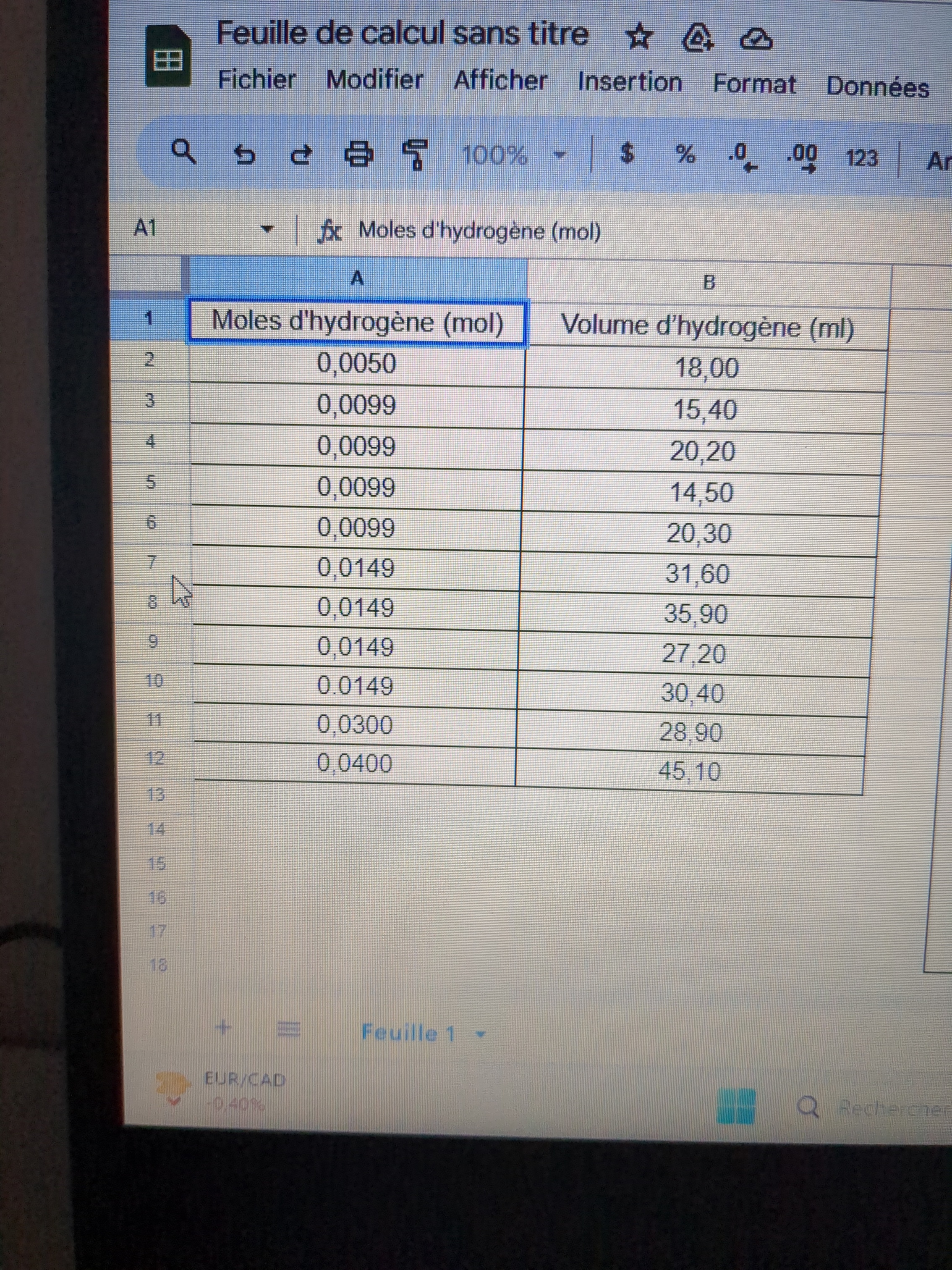
J'ai un rapport de laboratoire de chimie a rendre. Il nous demande de trouver le nombre de mol de H2 dans un volume déterminé de solution de H2.
Mon amie a fait une partie du tableau, mais je ne comprends pas comment elle a trouvé ces données et je suis supposée continuer le rapport et l'envoyer.
Merci beaucoup







Explication d'Alloprof
Cette explication a été donnée par un membre de l'équipe d'Alloprof.
Bonjour,
Si je comprends bien, tu as eu 0,01g de Mg qui ont r.agit complètement et tu veux trouver la quantité théorique de H2 ?
Dans ce cas on fait un problème de stoechiométrie.
1 mol de Mg produit 1 mol de H2
donc
24.31g de Mg produit 1 mol de H2
0,01 g de Mg produira combien de mol de H2 ?
On fait ( 0,01g* 1mol)/24.31g
ce qui donne 0.0004 mol de H2
Si je n'ai pas saisi le sens de ta question, peux-tu la reposer ?
Bonne journée!
Suggestions en lien avec la question
Suggestion en lien avec la question
Voici ce qui a été trouvé automatiquement sur le site, en espérant que ça t’aide!