Matières
Niveaux
L'équilibre chimique est un état dans lequel la vitesse de la réaction directe est égale à celle de la réaction inverse.
Dans la vie de tous les jours, le terme équilibre est employé pour décrire l'état de ce qui est immobile, de ce qui ne change pas. Par exemple, certaines structures rocheuses défient les lois de la gravité en formant un empilement à l'équilibre. Ce type d'équilibre est qualifié d'équilibre statique puisqu'il caractérise l'état de ce qui est immobile. Toutefois, les objets à l'équilibre ne sont pas toujours sans mouvement. Par exemple, un funambule maintient son équilibre tout en se déplaçant sur un fil. Il s'agit dans ce cas d'un équilibre dynamique.
En chimie, certaines réactions, plutôt que de se dérouler complètement, atteignent un état d'équilibre. Même si, à vue d'oeil, aucune transformation ne semble se dérouler, il y a en réalité un échange perpétuel entre les réactifs et les produits impliqués. La réaction atteint alors un équilibre dynamique.
Une réaction irréversible, ou complète, est une réaction qui ne peut se produire que dans un sens, des réactifs vers les produits. Elle survient lorsque au moins un des réactifs s'est complètement transformé en produits.
Une réaction réversible, ou incomplète, est une réaction qui peut se produire dans le sens direct autant que dans le sens inverse. Au même endroit et au même moment, les réactifs se transforment en produits alors que les produits se transforment en réactifs.
Certaines réactions ne peuvent se dérouler que dans le sens direct. Par exemple, lors de la combustion du bois, celui-ci réagit avec l'oxygène de l'air pour produire de l'énergie et se transformer en cendres et en fumée. La cendre et la fumée ne peuvent pas réagir pour reformer du bois: il s'agit d'une réaction irréversible. La décomposition des aliments est un autre exemple d'une réaction qui ne peut être inversée. Une réaction est donc irréversible lorsqu'elle est complète et qu'un ou plusieurs de ces réactifs se sont entièrement transformés.
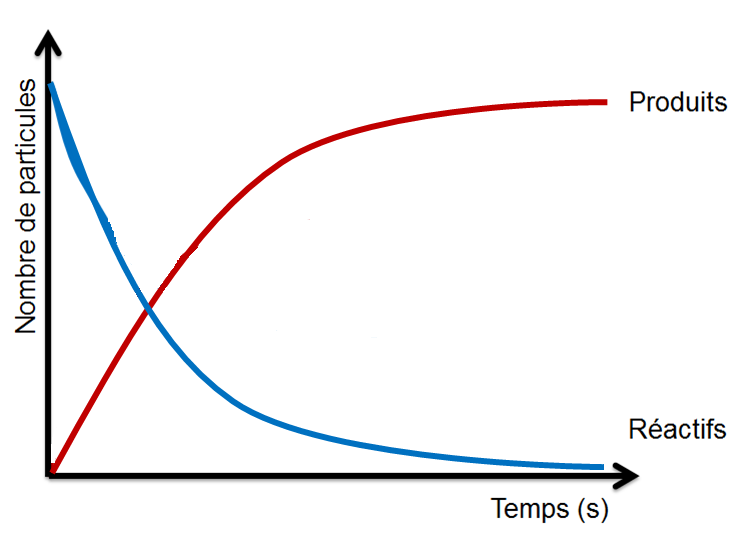
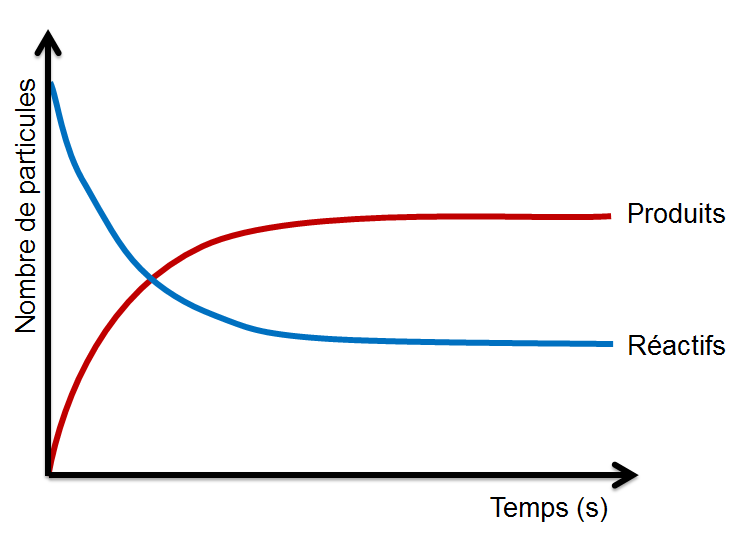
Toutefois, il arrive que certaines réactions peuvent se dérouler autant en sens direct qu'inverse. Puisqu'il se produit alors un constant va-et-vient entre les molécules de réactifs et celles des produits, aucune substance n'ait disparue. Il s'agit donc d'une réaction incomplète au cours de laquelle la réaction directe et la réaction inverse se déroule simultanément à la même vitesse. Dans une réaction réversible à l'équilibre, la quantité de produits et de réactifs demeure constante et aucun changement n'est apparent.
Dans une réaction irréversible (à gauche), au moins un des réactifs se transforment entièrement: la réaction est complète. Dans une réaction réversible (à droite), la quantité de produits et de réactifs atteint un état d'équilibre.
L'écriture des réactions irréversibles et réversibles diffère. Dans le cas d'une réaction chimique irréversible, une flèche à sens unique allant de gauche à droite signale que les réactifs deviennent entièrement des produits et que la réaction est complète. Pour une réaction réversible, c'est plutôt une double flèche qui sera employée afin d'indiquer que la réaction peut se dérouler dans les deux sens.
Réaction chimique irréversible: |CH_{4(g)} + 2\; O_{2(g)} \rightarrow CO_{2(g)} + 2\; H_{2}O_{(g)}|
Réaction chimique réversible: |H_{2(g)} + I_{2(g)} \rightleftharpoons 2\; HI_{(g)}|
L'état d'équilibre dynamique peut être physique ou chimique. En chimie, on distingue généralement deux types d'équilibre physique, l'équilibre des phases et l'équilibre de solubilité, ainsi que l'équilibre chimique.
L'équilibre des phases est observé lorsqu'une seule substance se trouve dans plusieurs phases au même endroit et au même moment.
L'équilibre des phases implique des transformations physiques de changement de phases. Par exemple, malgré des températures hivernales, l'eau d'un lac ne gèle pas complètement. Il ne se forme qu'une couche de glace en surface alors que le fond de l'eau reste sous forme liquide. Le processus de condensation solide n'est donc pas complet puisqu'il y a toujours présence du liquide initial. Le lac est donc à l'état d'équilibre puisque l'eau s'y retrouve sous deux phases simultanément. L'évaporation de l'eau dans une bouteille fermée à une température constante est un autre exemple d'équilibre de phases. L'eau de la bouteille s'évapore alors que la vapeur d'eau se condense simultanément.
L'équilibre de solubilité est observé lorsqu'une solution est saturée et qu'un dépôt de soluté apparaît.
Tous les solutés ont une solubilité maximale. Dépassé ce point de saturation, le soluté ne se dissout plus et se dépose plutôt au fond de la solution. Il est alors facile de penser que rien ne se déroule puisque le soluté ne se dissout plus. Au contraire, la solution a alors atteint un état d'équilibre. Le soluté en excès est continuellement en train de se dissoudre dans le solvant alors que la partie dissoute redevient à l'état solide. Ces deux processus opposés se déroulent à la même vitesse et simultanément, ce qui entraîne un état d'équilibre.
Exemple de solutions chimiques saturées
L'équilibre chimique est observé lorsque deux réactions chimiques opposées s'effectuent au même moment et à la même vitesse.
L'équilibre chimique est un équilibre plus complexe que les deux autres types d'équilibre dynamique puisqu'il met en jeu plusieurs substances ainsi que leurs transformations. Il doit donc y avoir au même moment au moins deux différentes substances: un réactif et un produit. L'équilibre chimique n'est parfois pas observable à l'oeil nu. Il faut alors vérifier si les conditions nécessaires à l'obtention d'un état d'équilibre sont présentes, ou encore se fier à l'écriture de la réaction chimique (donc d'y retrouver la double flèche).
Même si la transformation n'est pas visible à l'oeil nu, le peroxyde d'azote gazeux (incolore) se transforme constamment en dioxyde d'azote (brunâtre), et vice versa. La différence de couleur ici observée est imputable à la différence de pression présente dans les deux bouteilles. L'équation chimique de cette réaction s'écrit de la façon suivante : |2\; NO_{2(g)} \rightleftharpoons N_{2}O_{4(g)}|