La relation entre le volume et la pression (loi de Boyle-Mariotte)
La loi de Boyle-Mariotte est une loi simple des gaz.
La loi de Boyle-Mariotte
La loi de Boyle-Mariotte est une loi qui décrit la relation entre la pression |(P)| et le volume |(V)| d’un gaz.
On considère une quantité constante de gaz à une température donnée. Le gaz occupe un certain volume et ses particules exercent une certaine pression due à leurs collisions avec les parois du contenant.
Si on compresse le gaz de façon à avoir un plus petit volume, les particules sont plus serrées, ce qui engendre davantage de collisions. Il y a alors une plus grande pression sur les parois du contenant.
En somme, si le nombre de moles |(n)| et la température |(T)| sont constants, diminuer le volume de gaz |(V)| augmente la pression |(P)| qu’il exerce. À l’inverse, lorsque le volume augmente, la pression diminue.
On dit que la pression est inversement proportionnelle au volume. Cette relation peut s’exprimer à l’aide de la formule suivante.
À |T| et |n| constants :
|P\propto\frac{1}{V}| ou |PV= \text{constante}|
où
|P :| pression souvent en kilopascals |(\text{kPa})|
|V :| volume souvent en litres |(\text{L})|
On peut aussi comparer une situation initiale et une situation finale dans laquelle le volume et la pression d’un gaz ont changé. La formule suivante peut alors être employée.
À |T| et |n| constants :
|P_1V_1 = P_2V_2|
où
|P_1 :| pression initiale souvent en kilopascals |(\text{kPa})|
|V_1 :| volume initial souvent en litres |(\text{L})|
|P_2 :| pression finale souvent en kilopascals |(\text{kPa})|
|V_2 :| volume final souvent en litres |(\text{L})|
Attention!
Les lois simples des gaz s'appliquent uniquement pour les gaz parfaits. Autrement dit, les valeurs calculées à l'aide des lois simples nous donnent une approximation des valeurs qui seraient mesurées dans la réalité.
Tant que la température n'est pas trop basse et que la pression n'est pas trop élevée, ces valeurs approximées sont très utiles pour prévoir toutes sortes de situations.
Lorsqu’il se trouve à la surface de l’eau, un plongeur a un volume de |5{,}1\ \text{L}| d’air dans ses poumons à une pression de |101{,}3\ \text{kPa}.|
Il plonge ensuite à une certaine profondeur. La pression environnante est maintenant de |407{,}4\ \text{kPa}.| En supposant que la température |(T)| et la quantité d’air |(n)| dans ses poumons restent les mêmes, quel serait le volume de gaz dans les poumons du plongeur?

La loi de Boyle-Marriotte - Exemple
Voir la solution
Vidéo
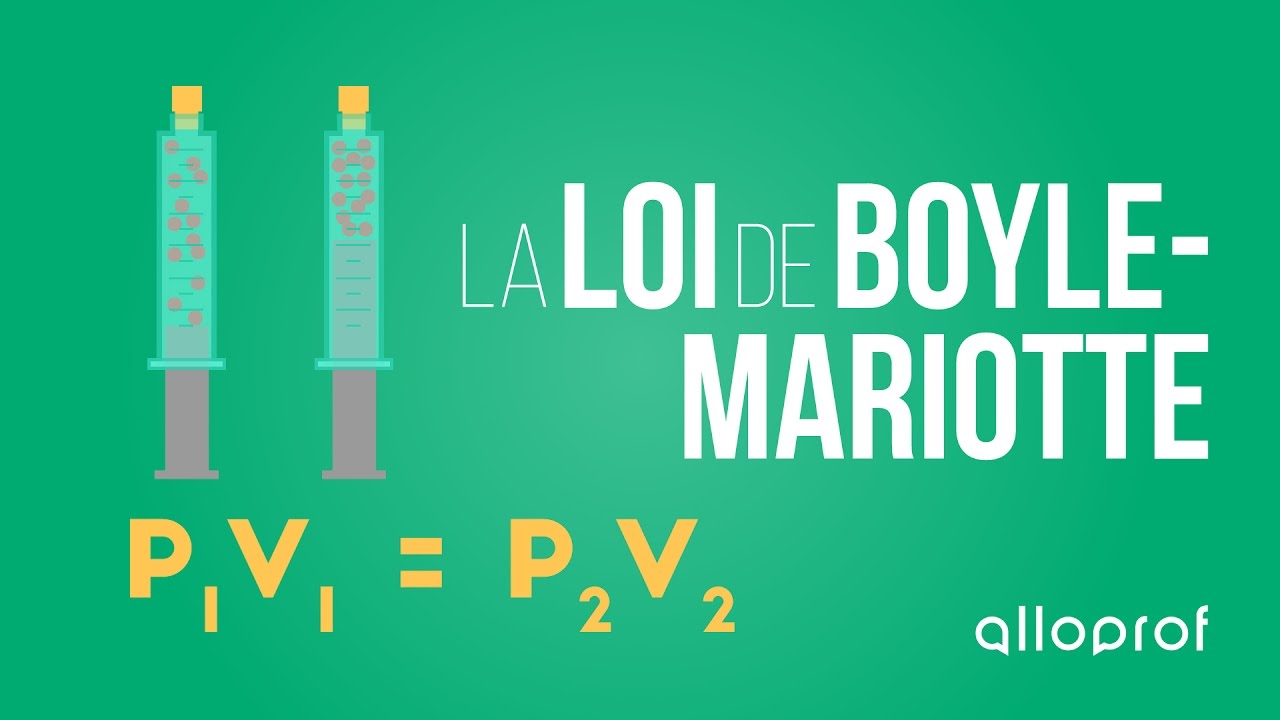
La loi de Boyle-Mariotte
Exercices
Exercices à venir.
À voir aussi
- La théorie cinétique des gaz
- Les lois simples des gaz
- La relation entre le volume et la température (loi de Charles)
- La relation entre la pression et la température (loi de Gay-Lussac)
- La relation entre le volume et le nombre de moles (loi d’Avogadro)
- La relation entre la pression et le nombre de moles
- La loi générale des gaz
- La loi des gaz parfaits
- La loi des pressions partielles (loi de Dalton)
Références
















































