La neutralisation acidobasique
Une neutralisation acidobasique est une réaction entre un acide et une base au cours de laquelle se forment un sel et de l'eau.
L'équation générale d'une neutralisation acidobasique est la suivante:
Acide+Base→Sel+Eau
Cette réaction peut également être écrite sous la forme suivante:
HA+BOH→AB+HOH
Voici quelques exemples de réactions de neutralisation acidobasique.
HCl+NaOH→NaCl+H2O
H2SO4+Ba(OH)2→BaSO4+2H2O
On peut aussi présenter une neutralisation selon le modèle particulaire.
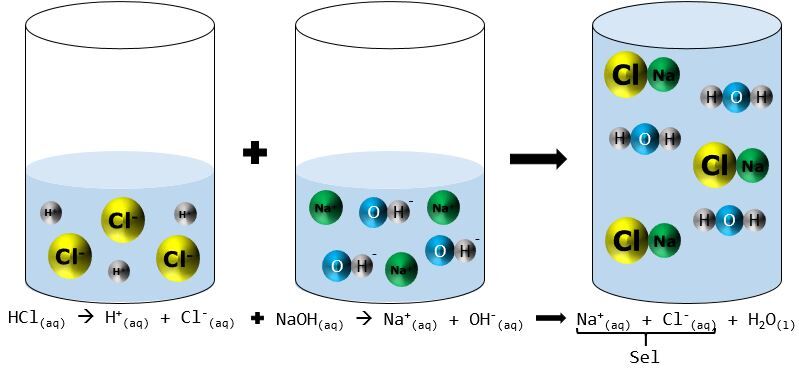
En milieu aqueux, l'acide chlorhydrique (HCl) se sépare pour former deux ions, H+ et Cl−. La base, l'hydroxyde de sodium (NaOH), se dissocie également en ions, Na+ et OH−. Lorsqu'on mélange l'acide avec la base, les ions H+ et OH− réagissent ensemble pour former de l'eau. Les deux autres ions, Na+ et Cl−, s'unissent pour former le sel, le chlorure de sodium (NaCl).
En somme, lorsqu’on neutralise une substance, on veut ramener son pH le plus près possible de 7. Les ions H+ et les ions OH− doivent être en même quantité pour que la solution soit dite neutre.
En laboratoire, la neutralisation acidobasique se fait généralement à l'aide d'une burette et d'un indicateur acidobasique. Il faut ajouter quelques gouttes d'indicateur acidobasique dans la solution à neutraliser. Selon la couleur obtenue avec l'indicateur, il faudra neutraliser avec un acide (si la solution est basique) ou avec une base (si la solution est acide). Il faut ensuite ajouter de la solution neutralisante goutte à goutte jusqu'à ce que la solution soit neutralisée, soit jusqu'à ce qu'il y ait autant d'ions H+ que d'ions OH−.
En savoir plus
Un acide peut être neutralisé par un carbonate comme dans l’exemple qui suit.
2HCl+CaCO3→CaCl2+H2O+CO2
Dans cette réaction de neutralisation, il y aura aussi une production de dioxyde de carbone (CO2). On pourra donc observer de l’effervescence lors de cette réaction.

La neutralisation acidobasique (titrage)
En savoir plus
Exercices



















































